IMMUNE EFFECTS OF COUMARIN COMBINED WITH INACTIVATED INFECTIOUS HEMATOPOIETIC NECROSIS VIRUS VACCINE ON RAINBOW TROUT (ONCORHYNCHUS MYKISS)
-
摘要:
开发安全有效的疫苗是预防虹鳟传染性造血器官坏死病毒(IHNV)爆发的关键。本研究重点开发了以香豆素为佐剂的IHNV灭活疫苗, 疫苗安全性实验证明IHNV病毒液已被完全灭活。实验分为对照组、疫苗组和香豆素+疫苗组。疫苗注射剂量为150 μL, 对照组注射同等剂量的磷酸盐缓冲溶液(PBS), 在疫苗接种14d (D14)后进行IHNV攻毒实验, 并在D7、D14、D15、D21、D30进行虹鳟脾脏和血清的样本采集。IHNV攻毒后显示, 香豆素+疫苗的存活率为66%, 而单一灭活疫苗和对照组的分别为62%和24%。组织病理学分析显示, IHNV攻毒后香豆素+疫苗组脾脏组织损伤最小, 出现轻微的炎症反应, 而对照组出现严重的黑色素巨噬细胞中心(MMC)和组织炎症(TI)。此外, 在D7—D30, 香豆素+疫苗组血清的总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)、碱性磷酸酶(AKP)、酸性磷酸酶(ACP)活性水平显著高于疫苗组和对照组(P<0.05)。在D7—D14, 香豆素+疫苗组血清中谷丙转氨酶(GPT)、谷草转氨酶(GOT)水平被显著升高; 而IHNV攻毒后(D15—D30), 香豆素+疫苗组GPT和GOT水平显著低于对照组(P<0.05)。在接种疫苗和攻毒后, 香豆素+疫苗组中脾脏的MHC-I、MHC-II和IFN-γ基因被显著上调(P<0.05); 同时, 香豆素+疫苗组CD4、CD8、IgT、C3、VIG1和Mx1基因表达量显著高于疫苗组和对照组(P<0.05)。结果表明, 灭活疫苗联合佐剂香豆素是预防IHNV感染的有效方法, 有助于进一步控制虹鳟养殖中的IHNV暴发。
Abstract:Infectious hematopoietic necrosis virus (IHNV) is one of the pathogens responsible for massive mortality in juvenile rainbow trout. Vaccines can induce immune response in the body, which leads to the production of appropriate antibodies that help protect against pathogen invasion. Therefore, the development of a safe and effective vaccine is the key for preventing IHNV outbreaks. Vaccine safety experiments revealed no clinical signs of IHN or mortality in rainbow trout, proving that the IHNV viral fluid was completely inactivated. The experiment was divided into control, vaccine, and coumarin+vaccine groups. The vaccine was injected in a dose of 150 μL, and the control group was injected with the same dose of phosphate buffer solution (PBS). The IHNV attack experiments were performed 14d post-vaccination (D14), and samples of rainbow trout spleen and serum were taken at D7, D14, D15, D21, and D30. The IHNV attack showed a survival rate of 66% in the coumarin+vaccine group compared to 62% in the inactivated vaccine group and 24% in the control group. Histopathological analysis showed minimal splenic tissue damage and mild inflammatory reaction in the coumarin+vaccine group after IHNV tapping, whereas the control group showed severe melanin macrophage center (MMC) and tissue inflammation (TI). In addition, at D7—D30, the serum levels of total superoxide dismutase (T-SOD), catalase (CAT), alkaline phosphatase (AKP), and acid phosphatase (ACP) activities in the coumarin+vaccine group were significantly higher than those in the vaccine and control groups (P<0.05). At D7—D14, the serum levels of ghrelin transaminase (GPT) and ghrelin oxaloacetate transaminase (GOT) were significantly elevated in the coumarin+vaccine group, while after IHNV attack (D15—D30), the levels of GPT and GOT in coumarin+vaccine group were significantly lower than those in the control group (P<0.05). Gene expression analysis showed a significant upregulation of MHC-I, MHC-II, and IFN-γ in the spleen in the coumarin+vaccine group after vaccination and IHNV challenge (P<0.05). Meanwhile, the expression of CD4, CD8, IgT, C3, VIG1, and Mx1 genes was significantly higher in the coumarin+vaccine group than that in the vaccine and control groups (P<0.05). These results suggest that an inactivated vaccine combined with the adjuvant coumarin is an effective method for preventing IHNV infections, which may help to further control IHNV outbreaks in rainbow trout farming.
-
Keywords:
- Coumarin /
- Vaccine /
- Rainbow trout /
- Immune effect /
- IHNV
-
虹鳟(Oncorhynchus mykiss)是一种优质的冷水鱼, 具有良好的营养品质和加工性能。近年来, 由于国内虹鳟市场的巨大缺口, 虹鳟养殖规模急剧增长[1]。因此, 养殖模式从以前的半密集型转变为更密集型, 这也增加了鱼类对传染病的易感性[2]。1985年传染性造血器官坏死病毒(Infectious Hematopoietic Necrosis Virus, IHNV)传播到中国, 而后在辽宁、甘肃、青海等地出现大规模暴发, 使得虹鳟养殖业遭受了近乎毁灭性的打击[3, 4]。虹鳟造血器官坏死病(Infectious hematopoietic necrosis, IHN)的病原体是一种弹状病毒科病毒, 具有高度传染性。当水温为10—12℃时, 死亡率为70%—100%[5]。感染IHNV的虹鳟的症状通常包括眼球突出、鱼的体表变黑、鳃苍白、腹部肿胀以及体表和体内出血, 目前没有特效药可用于治疗[6, 7]。
传统上, 许多抗生素用于治疗这些疾病, 然而, 病原体的抗生素耐药性逐渐增加, 这些化学产物可以在动物组织中积累, 导致动物免疫抑制和环境污染[8, 9]。近几十年来, 疫苗、益生菌、草药和益生元等替代方法已被引入水产养殖业, 以预防疾病暴发[10]。疫苗接种通常是预防病毒性传染病的有效方法, 灭活疫苗在鱼类疫苗应用中占主导地位[11, 12]。先前的研究表明, 灭活的神经坏死病毒(RGNNV)疫苗可有效激活七带石斑鱼幼鱼的先天和适应性免疫, IHNV攻毒后的鱼类的相对存活率为67%[13]。在金鱼(Carassius auratus)中, 灭活的CyHV-2 (鲤疱疹病毒2型)疫苗激活了免疫反应, 免疫基因(MX1、IFN-γ、CD8和CD4)显著上调, 受到CyHV-2疫苗攻毒后的鱼的存活率为86.7%[14]。一般来说, 灭活疫苗引发广泛的体液免疫, 但对细胞免疫的刺激作用相对较弱[11]。联合给药佐剂可能是一种增强灭活疫苗免疫效果的策略, 所以选择合适的佐剂可以刺激机体产生更强烈持续的免疫反应[10, 15]。
天然化合物作为佐剂在水产养殖中的应用已越来越广泛。例如香豆素(图 3)、黄芪多糖、β-葡聚糖和复方人参茎叶皂苷。香豆素与灭活疫苗联合使用显著提高了银鲫(Carassius auratus gibelio)对CyHV-2感染的相对免疫保护作用, 并对血清溶菌酶(LZM)、总超氧化物歧化酶(T-SOD)和补体C3产生了更好的效果, 并增强了重要免疫基因(IL-1β、IgM、IL-2和IFN-γ2)的mRNA表达[16]。此外, 含有复方人参茎叶皂苷的灭活疫苗更有可能诱导大菱鲆更高的细胞免疫反应。这些研究推断, 通过开发有效的疫苗和佐剂来对抗IHNV感染是一种很有前途的策略。香豆素是从兰花、黑豆等天然草本植物中提取的化合物, 主要从豆科植物中提取[17], 具有良好的抗氧化、抗凝血、抗菌、抗炎、抗病毒和抑制酶的生理活性[18]。多项研究表明, 香豆素是一种有效的抗病毒药物, 包括抗肝炎病毒[19]、流感病毒[20]、登革热病毒[21]。香豆素还通过激活IFN反应在体外和体内对IHNV感染具有积极抑制作用[22]。据先前的研究所知, 该领域尚未涉及香豆素与灭活IHNV疫苗联合对虹鳟的免疫调节作用。本研究开发了一种以香豆素为佐剂的IHNV灭活疫苗, 并在虹鳟身上测试了其有效性。这项研究为预防鱼类病毒性疾病提供了一种可行的策略, 并有助于更好地了解佐剂和灭活疫苗组合在虹鳟抗IHNV上的分子机制。
1. 材料与方法
1.1 实验用鱼类、病毒和细胞
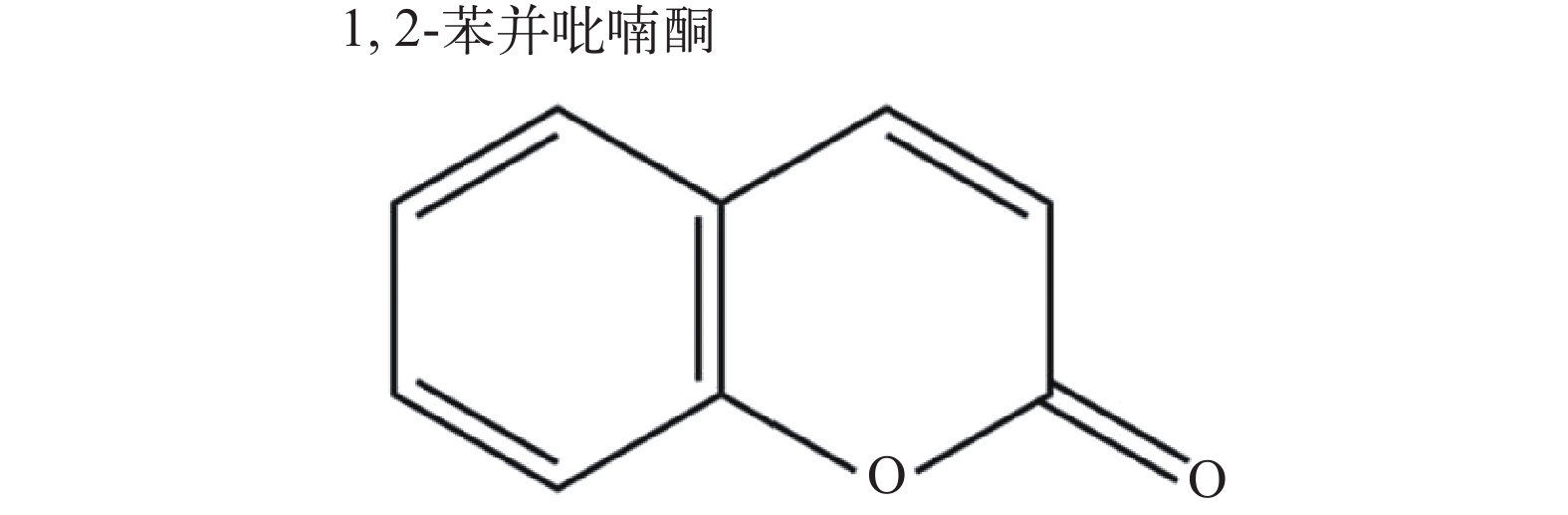
健康的虹鳟[(85±0.5) g]购自甘肃某虹鳟鱼场, 鱼在1000 L的水箱中暂养二周, 水温为(12±1)℃。在实验前期, 通过实时荧光定量PCR技术随机检测6条虹鳟发现其体内没有IHNV, 说明实验采用的是健康虹鳟。在鱼类实验期间, pH范围为7.6—7.8, 溶解氧约为8.5 mg/L。在整个实验过程中, 每天用商业颗粒饲料喂养两次。IHNV GS毒株由本实验室保存, 并在15℃的EPC细胞系中繁殖。EPC细胞在25℃二氧化碳细胞培养箱中用M199培养基(Sigma, St.Louis, MO, USA)静态培养, 该培养基补充有10% FBS(胎牛血清; Gibco)、100 U/mL青霉素和100 mg/mL链霉素。香豆素C9H6O2 (图 1; 分子量为146.14)储存于4℃冰箱。
1.2 IHNV灭活疫苗及其佐剂的制备
甲醛价格低廉, 在现有的商业疫苗中应用广泛, 因此选择甲醛作为IHNV的灭活剂来制备灭活疫苗。取IHNV病毒溶液(107 TCID50/mL), 加入甲醛(终浓度0.25%)并快速混合。将添加甲醛的病毒溶液置于24℃、100 r/min的摇床上24h进行灭活, 然后加入亚硫酸氢钠溶液(终浓度1 mmol/L)终止灭活, 获得IHNV灭活溶液。通过0.22 μm膜过滤上述灭活病毒溶液, 收集滤液并储存在4℃下。将香豆素(Sigma-Aldrich, St.Louis, MO, USA)加入DMSO溶液中, 并在200 r/min下搅拌30min, 以形成100 μg/mL的香豆素母液。香豆素佐剂溶液通过0.22 μm膜过滤以收集滤液, 后取母液香豆素溶剂加入IHNV灭活液也就是形成终浓度为0.1 μg/mL 香豆素+疫苗溶液, 并储存在4℃下。以用来测试佐剂疫苗的组合效果。
1.3 疫苗安全性试验
在细胞水平和动物水平上检测了甲醛灭活剂灭活IHNV的有效性。在细胞水平上, 将制备的IHNV甲醛灭活疫苗接种在六孔板中的EPC细胞上。连续观察EPC细胞是否存在细胞病变效应(CPE), 如果没有观察到CPE, 则将EPC细胞盲传代连续三代以观察EPC细胞的变化。如果第二个观察期没有CPE, 则将细胞置于–80℃冰箱中进行两次重复冻融, 在5000 r/min 4℃下离心10min以收集上清液, 然后在上清液中接种连续三代的盲传代细胞以观察细胞状态。如果在第三个观察期的盲传代中都没有看到CPE, 则病毒被完全灭活。在动物水平上, 虹鳟腹腔内注射用甲醛灭活剂制备的灭活疫苗, 以150 μL的剂量免疫无病原体的虹鳟鱼。注射等剂量PBS的虹鳟作为阴性对照。连续21d观察虹鳟的摄食状况及临床症状。
1.4 疫苗接种、攻毒、采样和存活测定
将鱼分为3个组(疫苗+香豆素、疫苗和对照组), 以测试佐剂疫苗组合的免疫保护作用。每个实验组有150条鱼, 其中100条鱼用于死亡率测量, 其余50条鱼用于采样。疫苗和佐剂组合疫苗均以100 μL在虹鳟腹膜内注射, 对照组在相同条件下注射100 μL PBS。在接种疫苗后第14天(D14), 每组150条鱼用50µL IHNV (107 TCID50/mL)进行腹膜内攻毒, 并监测两周的死亡率。在D7、D14、D15、D21和D30分别处死每个处理组的6条鱼进行脾脏和血液采集, 以测定免疫相关基因表达和非特异性酶活性。此外, 在D7、D14、D15、D21和D30采集3条鱼的脾脏进行组织病理学检查。
1.5 组织病理学检查
将收集的脾脏样品在Davidson固定剂中快速固定24h, 然后转移到70%乙醇中。固定样品通过常规石蜡包埋技术进行处理。用高浓度的乙醇脱水, 在二甲苯中浸泡, 并在60℃下包埋在石蜡中。使用切片机将石蜡块切成3微米厚的组织切片。然后进行苏木精染色, 中性树胶封片后, 使用显微镜观察并拍照。
1.6 酶活性分析
将采集的血样在室温下放置1h。通过离心机(Multifuge X1R, Thermofisher, US)在4℃、4000 r/min下离心10min后, 收集血清样品。使用商品试剂盒(南京建诚有限公司)测定血清中总蛋白含量(TP)、碱性磷酸酶(AKP)、酸性磷酸酶(ACP)、胆红素(TBIL)、谷草转氨酶(GOT)、谷丙转氨酶(GPT)、过氧化氢酶(CAT)和总超氧化物歧化酶(T-SOD)的活性。
1.7 免疫相关基因表达分析
脾脏样品(D7、D14、D15、D21和D30)根据制造商的说明书通过使用研磨机(60 Hz, 1min)进行充分研磨, 并且在研磨后向每个样品中加入1 mL TRIzol试剂(Invitrogen Life Technologies)提取来自脾脏的总RNA。使用NanoDropND-1000分光光度计(Thermo Scientific)检测RNA浓度及纯度, 并通过琼脂糖凝胶电泳测定其完整度。使用逆转录试剂盒(Accurate Biotechnology, 中国湖南)将RNA逆转录为cDNA。所有qRT-PCR均在QuantGene 9600系统(Bioer Technology)上使用EvaGreen 2×qPCR Master mix (Accurate Biotechnology, 中国湖南)进行。虹鳟β-肌动蛋白作为正常表达的对照基因。Primer 5.0软件用于设计免疫相关基因的特异性引物(表 1)。使用qRT-PCR对虹鳟样本进行检测, 每个样本设置3个平行。通过2–ΔΔCt方法计算基因表达, 并表示为平均值±标准差(SD)。
表 1 RT-qPCR所用引物及其序列Table 1. Primers and sequences used for RT-qPCR引物名称
Primer上游引物序列
Primer sequence (5′—3′)下游引物序列
Reverse primer sequenceMX1 TCGGCAGAGAGGCTGTATTT TTGAGACGAACTCCGCTTTT IFN-γ GCCATGAAACCTGAGAGGAG TCTTTGCAGATGACGTTTCG MHC-I GACAGTCCGTCCTCAGTGT CTGGAAGGTTCCATCATCGT MHC-II TGCCATGCTGATGTGCAG GTCCCTCAGCCAGGTCACT CD4 CCTGCTCATCCACAGCCTAT CTTCTCCTGGCTGTCTGACC CD8 AGTCGTGCAAAGTGGGAAAG GGTTGCAATGGCATACAGTG C3 CACCCACCACCATACCAA GCTACGATGCGGAACGAC IGT AGCACCAGGGTGAAACC GCGGTGGGTTCAGAGTC VIG1 CTACAATCAAGGTGGTGAACAATGT GTGGAAACAAAAACCGCACTTATA 2. 结果
2.1 健康虹鳟IHNV随机检测
在实验前, 通过实时荧光定量PCR技术随机检测6条虹鳟, 用感染IHNV的虹鳟鱼作为对照组。结果表明实验用鱼无荧光信号(图 2), 说明实验用鱼均为健康虹鳟。
2.2 灭活疫苗的安全性和保护效力
在本研究中, IHNV甲醛灭活疫苗的安全性实验表明, 在细胞水平上, EPC细胞在第三个观察期显示细胞无病变效应(CPE; 图 3), 说明病毒已被完全灭活。在动物水平上, 在无病原体的虹鳟腹膜内注射甲醛灭活疫苗后, 经过连续21d观察虹鳟, 发现虹鳟均摄食正常, 未出现IHNV的临床症状和死亡现象。
经疫苗安全性验证实验后的IHNV甲醛灭活疫苗, 在虹鳟腹膜内注射50 µL IHNV (107 TCID50/mL)攻毒, 并监测两周的死亡率。结果发现, 对照组虹鳟攻毒后第14天累计存活率为24%, 疫苗组存活率为62%, 添加香豆素+疫苗组存活率为66% (图 4)。因此, 在IHNV灭活疫苗中添加合适的免疫佐剂能够提高疫苗的免疫保护率。
2.3 组织病理学观察
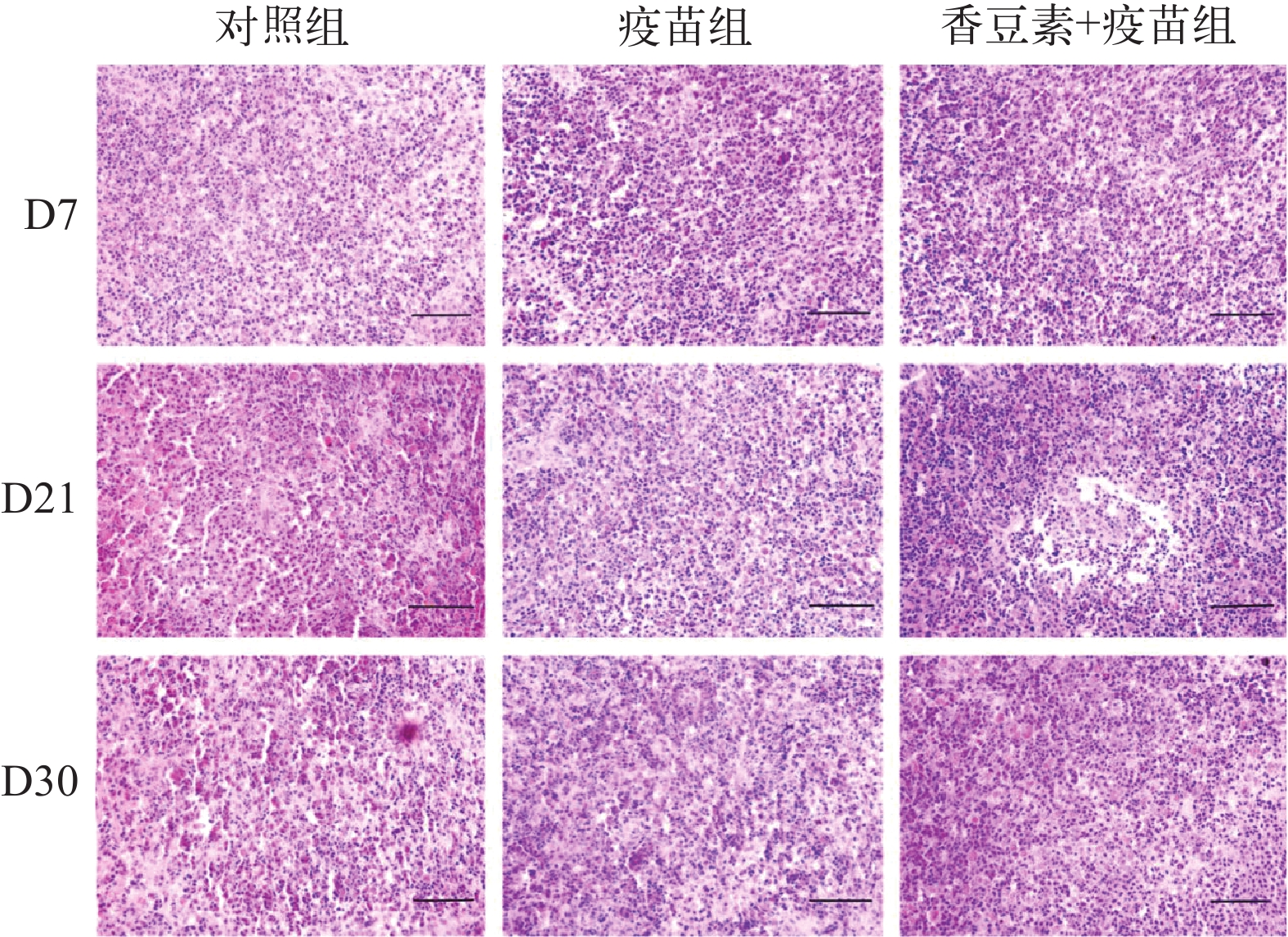
在D21对照组中, 虹鳟表现出典型的IHN症状, 表现为眼球突出、体色变深。疫苗组和香豆素+疫苗组的虹鳟在D21时没有表现出显著的临床症状(图 5)。脾脏是主要的病变器官, 因此进行了组织病理学观察。D7时, 对照组细胞形态和排列正常, 脾脏无炎性细胞的浸润, 核仁明显, 细胞界限清晰, 红髓内淋巴细胞正常。疫苗组和香豆素+疫苗组中脾脏红细胞略有增加, D30各组(IHNV攻毒后)观察到不同程度的黑色素巨噬细胞中心(MMC)和组织炎症(TI)。对照组观察到严重的MMC和TI, 疫苗组MMC和TI症状较弱, 而香豆素+疫苗组显示轻度MMC和TI(图 6)。
2.4 虹鳟血清生化指标检测
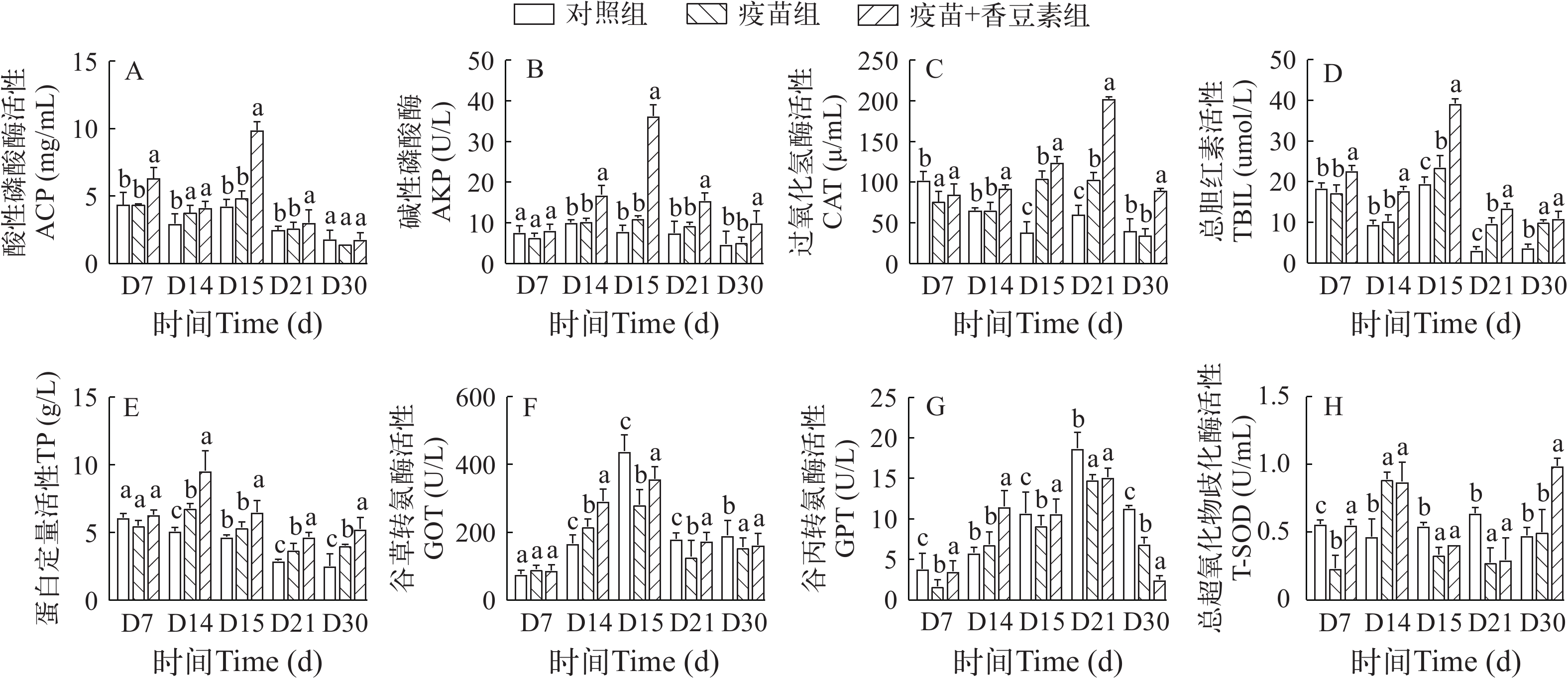
在免疫后, 疫苗组和香豆素+疫苗组SOD活性增加(D14), 在D14至D21缓慢下降; D30时, 疫苗组和香豆素+疫苗组的SOD活性再次升高(图 7H)。值得注意的是, 香豆素+疫苗组的T-SOD在D30时达到最大值, 且显著高于对照组(图 7H; P<0.05)。与对照组相比, 疫苗组和香豆素+疫苗组的CAT活性在接种早期呈缓慢增加的趋势; 在IHNV攻毒后, 香豆素+疫苗组的CAT活性迅速增加且显著高于对照组(图 7C; P<0.05), 并在D21达到峰值。GOT活性在免疫后均升高, IHNV攻毒后对照组的GOT迅速升高(D15), 且显著高于香豆素+疫苗组。在D15、D21、D30时, 对照组的GOT活力显著高于疫苗组和香豆素+疫苗组(图 7F; P<0.05)。在IHNV攻毒后, GPT活力在D21时, 对照组达到峰值, 且显著高于疫苗组和香豆素+疫苗组(图 7G; P<0.05)。在免疫后, AKP、ACP、TBIL在IHNV攻毒后D15活性最高, 且香豆素+疫苗组显著高于对照组和单一灭活疫苗组(P<0.05; 图 7A—D)。此外, 在本实验中TP在IHNV攻毒后(D15、D21、D30), 其在香豆素+疫苗组中的活性显著高于对照组(图 7E; P<0.05)。
2.5 脾脏免疫相关基因的动态表达
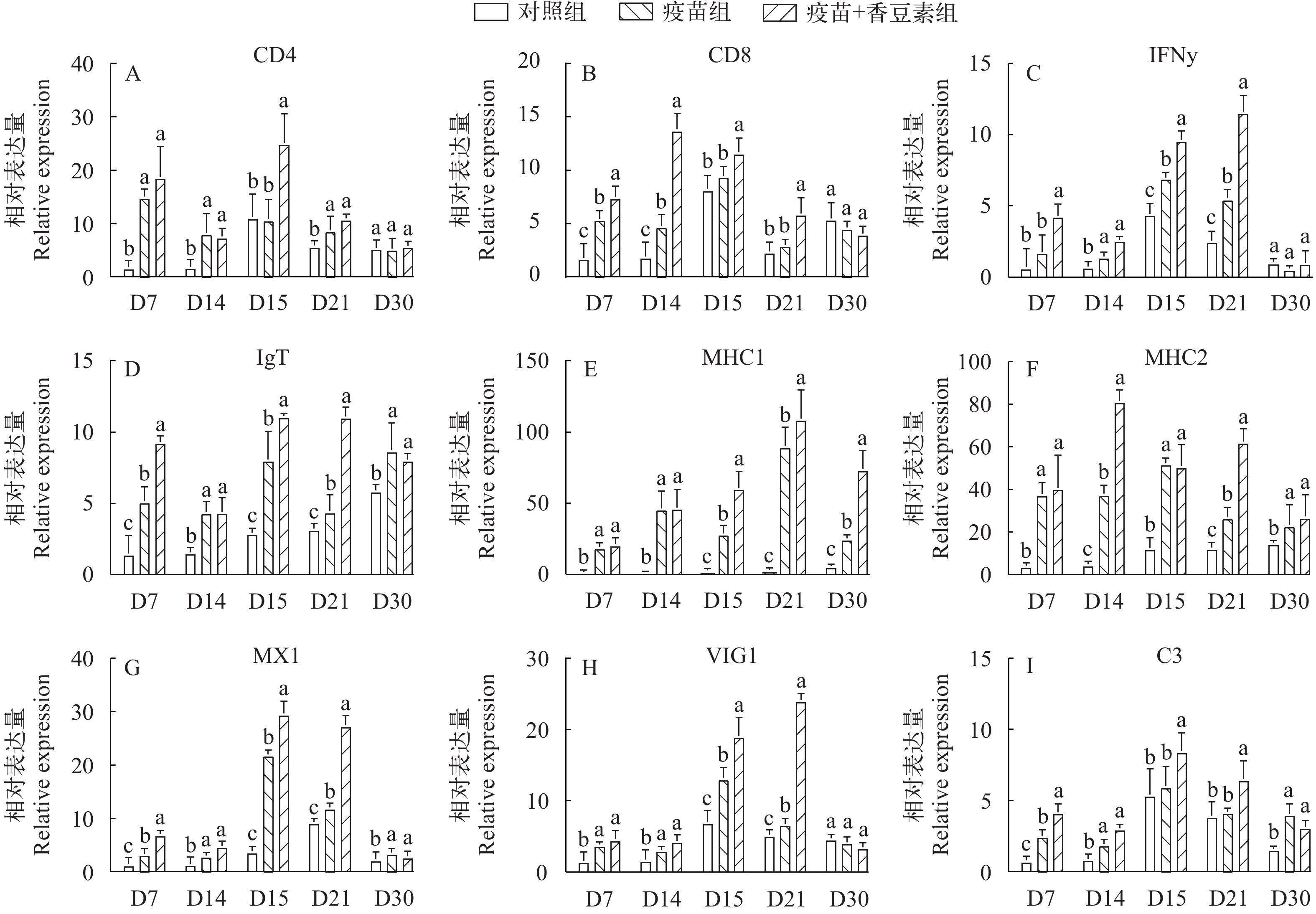
为了评估虹鳟对疫苗接种的免疫反应动力学, 通过qRT-PCR在D7、D14、D15、D21、D30分别测定虹鳟脾脏9个免疫相关基因的表达, 包括MHC-I、MHC-II、IgT、C3、CD4、IFN-γ、MX1、VIG1和CD8。以PBS注射虹鳟组作为阴性对照, 在免疫组虹鳟中, 特别是在香豆素+疫苗组中, 这些基因在免疫后早期(D7、D14)在脾脏中的表达显著上调(图 8; P<0.05)。在D15时, MX1、CD4、CD8和C3的表达开始降低。值得注意的是, 相比于对照组, 香豆素+疫苗组在IHNV攻毒后(D14) MHC-II和CD8基因的表达迅速增加(图 8; P<0.05)。此外, 在IHNV攻毒的后期(D21、D30) CD4和CD8基因的表达减少, 各组之间没有显著差异。在IHNV攻毒后, 香豆素+疫苗组IGT基因表达水平长期处于高水平阶段。
3. 讨论
IHN是一种的弹状病毒所引起的传染病。临床感染最常见鱼苗和幼鱼[6]。近年来, IHN在中国的虹鳟养殖区域流行, 对经济产生了重大影响; 这些农场的累计死亡率可达到90%—95%[3, 4]。许多针对IHNV感染的新的有效疫苗已经开发出来, 但它们的安全性和高成本阻碍了它们的实际应用。目前, 注射灭活疫苗广泛用于水产养殖, 与其他疫苗接种方法相比(口服和浸泡疫苗), 能诱导更强的免疫力。因此, 开发安全有效的注射疫苗对预防水生动物疾病具有重要意义。此外强大的体液和细胞免疫对预防和清除病原体发挥着至关重要的作用, 香豆素已被证明可以刺激B细胞增殖, 增加抗体和体外IgG的产生, 它还可以作为佐剂增强疫苗保护效力[20, 21]。本研究开发并测试了灭活的IHNV疫苗和香豆素联合后疫苗的安全性、免疫原性和保护效力。对此优先考虑候选疫苗的安全性。由于本实验中香豆素属于脂溶性药物, 使用了DSMO作为溶剂, 研究证实斑马鱼胚胎暴露于1% DMSO浓度时, 没有观察到畸形或致死率的增加。说明可以安全地使用浓度高达1%的DMSO来溶解斑马鱼胚胎发育毒性测定(ZEDTA)中的化合物[23]。采用DMSO配制化合物进行细胞给药时, DMSO的终浓度控制在0.1%以内是被认为对细胞实验没有干扰的。在此次生物实验中, 我们将DMSO浓度稀释到0.1%以下, 减少非药物因素对实验的影响。在这项研究中, 接种灭活疫苗的虹鳟鱼没有出现临床症状或死亡现象, 这与接种DNA疫苗的虹鳟鱼结果一致[24]。接种灭活的IHNV疫苗后, 脾脏细胞轻微增大。这可能是由于疫苗促进的炎症反应或生长性能[25]。尽管如此, 研究结果表明, IHNV灭活疫苗是相对安全的。另外, 先前的研究表明, 香豆素对感染病毒的鱼类具有抗IHNV作用, 大大提高了存活率[22]。本研究发现IHNV攻毒后, 对照组、疫苗组和香豆素+疫苗组虹鳟的存活率分别为24%, 62%和66%。结果表明IHNV灭活疫苗与香豆素联合使用可以增加虹鳟鱼的存活率。这与在福尔马林灭活疫苗中添加多聚半乳糖苷(PA)、富含CpG的质粒(pCpG)和铝佐剂能提高大黄鱼的存活率研究一致[26]。这说明香豆素作为免疫增强剂能提高虹鳟病毒感染后的存活率, 降低鱼体内病毒载量, 抑制IHNV的水平传播[27]。
3.1 IHNV攻毒后对虹鳟脾脏组织切片的影响
脾脏是主要的免疫器官, 病理切片可以直接反应致病性感染的病理损伤。在免疫刺激后, 脾脏中的黑素巨噬细胞增多, 并与淋巴细胞和抗体生成细胞聚集在一起形成黑素巨噬细胞中心, 对血液中异物有很强的吞噬能力。先前的研究发现, 在感染ISKNV鳜鱼腹腔注射茴香胺疫苗混合物后, 通过组织切片观察发现, 在感染组中出现大量的黑色素巨噬细胞和组织炎症, 而茴香胺+疫苗组中出现轻微炎症反应[28]。此外, 香豆素抑制IHNV诱导的EPC细胞凋亡, 并保存正常的细胞形态结构, 反应在保护EPC细胞免受细胞肿胀、细胞凋亡体的形成、细胞核碎裂[22]。在本研究中发现D21对照组中出现了巨噬细胞和少量红细胞, 且组织发生炎症反应, 细胞形状和大小发生了变化。香豆素联合疫苗组中出现轻度的炎症反应, 细胞形态无明显变化。这可能表明在消灭病原体的过程可能使用了黑素巨噬细胞。这些组织病理学切片结果反应了添加香豆素的疫苗组对感染的自然抵抗能力更强, 病理改变水平低, 说明香豆素+疫苗组能够提高虹鳟对IHNV的抵抗作用。在D30, 对照组脾脏中淋巴细胞明显减少, 有不同程度的黑色素巨噬细胞聚集, 出现炎症反应, 细胞排列紊乱, 弥散度高, 脾小体结构不完整, 可能是由于炎症反应引起损伤和破坏, 纤维组织增生可能是免疫功能异常所致。另外, 对照组脾脏内红细胞增多, 组织充血。可能是由于炎症反应导致的组织水肿或病毒感染后脾脏内部的血管破裂或出血所致。而香豆素联合疫苗组脾脏组织病变水平低, 说明在感染过程中香豆素联合疫苗可有效抑制脾脏的损伤。
3.2 虹鳟血清免疫相关酶活性的影响
疫苗的持久性被认为是长期保护和增强鱼类免疫保护反应所必须的, 血清生化指标的测定已被广泛应用于鱼类生理的临床诊断, 以确定鱼类的总体健康状况[29]。过氧化氢酶(CAT)和总超氧化物歧化酶(T-SOD)是应对氧化应激的关键酶, 能够有效保护组织免除自由基损伤。香豆素具有抗氧化性能, 能够减少自由基对免疫细胞的损伤, 使免疫细胞可以维持正常生理功能, 增强机体免疫力[30]。前人研究发现香豆素增强斑马鱼体内的抗病毒免疫应答, 并通过提高鱼体内的氧化酶活性维持被病毒破坏的氧化系统平衡, 最终有效降低斑马鱼在感染SVCV后的死亡率[31]。还有将黄氏多糖和鲟嗜水汽单胞菌灭活疫苗配伍注射鲟鱼, 得到黄氏多糖佐剂组与其他组SOD值差异显著[32]。本研究发现SOD和CAT在攻毒后, 香豆素+疫苗组其抗氧化酶活性相比于对照组显著上调, 说明机体为了抵御IHNV入侵产生了强烈的氧化应激反应。香豆素作为疫苗佐剂注射在接种IHNV灭活疫苗的虹鳟体内, 可显著增高虹鳟的抗氧化酶活性。
ACP在酸性环境下能够水解外源异物的磷酸酯外表面, 不仅参与细胞内生物大分子的消化过程, 还在免疫系统中发挥关键作用, 确保细胞的正常代谢活动得以维持。这一功能对于维持生物体的健康状态至关重要[33]。AKP作为巨噬细胞溶酶体的标志性酶, 也是一种重要的代谢调控酶, 直接参与磷酸基团的转移和代谢循环, 杀灭外来入侵病原微生物, 其活性的高低反映出鱼体免疫应答的能力。大量研究表明, 生物佐剂(如β-葡聚糖、茴香胺、壳聚糖、APS)可显著提高灭活疫苗的免疫效果[34—37]。先前研究发现, 在鳜鱼腹腔注射壳聚糖混合疫苗, 壳聚糖+疫苗组的ACP和AKP活性相比于对照组显著增加[28]。本研究发现, 攻毒后香豆素+疫苗组血清中的ACP和AKP在诱导后显著增加, 相比之下, 在D30对照组和疫苗组的ACP和AKP水平没有明显变化, 这些结果强化了抗原需要佐剂来增强其功能的观点。此外, 谷草转氨酶是维持鱼类心肌正常生理功能的关键酶指标, 谷丙转氨酶是鱼体能量代谢的关键酶。一般情况下2种酶活性较低, 但当肝脏受损则会大量释放到血液中从而导致酶活力异常升高, 故其活性是检测肝脏损伤程度的重要指标。先前研究发现, 与健康人相比, 新冠肺炎患者在免疫接种后的GOT、GPT水平较低[38]。这些结果与当前结果相似, 即血清中GOT和GPT活性在对照组中最高, 且显著高于香豆素联合疫苗组, 说明香豆素联合疫苗能保护虹鳟抵御IHNV。
在任何物种中, 疫苗的成功依赖于增强免疫记忆的能力, 以更大的活力应对由同一抗原引起的感染。血液中总蛋白(TP)反映机体对蛋白质的吸收、合成、分解等代谢状况。在免疫后, 香豆素+疫苗组TP在IHNV攻毒后显著上调(D14)。与本研究类似的是, 当对黄颡鱼施用APS和疫苗组合时, TP含量显著增加[37]。说明香豆素作为免疫增强剂可以增加鱼体内免疫细胞的活性和数量, 同时与疫苗有协同作用, 增加鱼体内抗体和其他免疫蛋白的产生, 从而增加TP水平。血清中胆红素(TBIL)主要由衰老红细胞破坏后的血红蛋白衍化而来, 可作为评价肝组织损伤的指标之一[39], 在本研究中, TBIL含量先降低后升高, 可能是肝细胞受损而降低了从血液中吸收胆红素的能力。而香豆素+疫苗组的TBIL含量显著高于对照组(D14), 说明在单一灭活疫苗中添加香豆素对IHNV感染具有一定的保护作用。
3.3 香豆素联合疫苗对虹鳟免疫相关基因的影响
接种疫苗已被认为是对抗传染病最有效的方法, 然而, 仅含有抗原的疫苗往往抗原性不足, 无法引发足够有效的免疫反应, 因此需要佐剂辅助。香豆素可以调节炎症反应, 能够抑制炎症发生时炎症介质的产生和释放, 防止炎症的过度发展, 有助于避免炎症对免疫系统的干扰, 从而提高机体免疫能力[40]。IFN-γ已被广泛用作疫苗反应性的标记物。虹鳟免疫接种含香豆素的IHNV灭活疫苗后, 可诱发产生IFN介导的先天性免疫反应, 诱导 Mx蛋白基因的表达上调, 并且在一定程度上可以抵抗机体感染病毒[41], 本研究发现, 与对照组相比, 香豆素联合疫苗在脾脏中, IFN-γ基因在D15, D21时均显著升高, 这与以前的研究结果一致, 在虹鳟胚胎中, IFN产物诱导蝰蛇素显著上调, 并对IHNV具有很强的抗病毒活性[42]。此外, MX1基因在免疫后D15显著上调, 这与香豆素通过增加斑马鱼的先天免疫反应, 诱导干扰素相关基因表达的上调的研究结果相似[43]。这说明香豆素联合疫苗能刺激免疫细胞并引起机体产生先天性免疫应答。
此外, 一些细胞免疫相关基因, 包括CD4、CD8、MHC-I、MHC-II的基因表达在接种疫苗后上调。这些基因被认为是抗原呈递相关基因。MHC-I可结合来自细胞内源性抗原的肽段, 与CD8+T细胞结合后, 可激活T细胞, 使其识别并杀伤感染细胞或癌变细胞。MHC-II可结合细胞外源性抗原的肽段, 与CD4+T细胞结合后, 可激活T细胞, 激活巨噬细胞吞噬病原体。此外, 细胞自噬可以通过胞内感受器激活宿主天然免疫系统, 并将病毒抗原呈递给MHC-II类分子激活适应性免疫, 发挥抗病毒作用。在先前的研究中发现, 在接种疫苗后罗非鱼的脾脏中, 观察到CD4和MHC-II显著上调[44]。这与本实验中MHC-I和MHC-II基因在攻毒后免疫虹鳟脾脏中显著上调结果一致。研究表明香豆素衍生物在EPC细胞和幼鲤中对SVCV (鲤春病毒血症病毒)感染具有强力的抑制作用, 减少病毒诱导的细胞凋亡, 对宿主产生直接保护作用[31]。上述结果说明, 该香豆素联合疫苗免疫虹鳟后可诱导机体产生非特异性免疫应答反应, 可有效抵御IHNV的感染。
先天性免疫是抵御病原体入侵的第一道防线。在识别抗原和响应病原体方面具有特定的作用。在硬骨鱼中, IgT对于黏膜免疫反应及其重要, 是一种专门用鱼黏膜免疫的原始免疫球蛋白类别, 疫苗的长期记忆功效可通过黏膜相关的IgT的特异性刺激来诱导产生[45]。本研究发现, IgT基因在攻毒后, 香豆素联合疫苗组长期处于高水平阶段。与这个结果一致的是, 接种过疫苗的虹鳟鱼在受到耶尔森氏菌攻毒后, 其脾脏、肝脏和头肾组织中IgT被大量表达[46]。另外, 补体C3是鱼类免疫应答的重要效益因子, 具有介导炎症和调理免疫细胞等作用[47]。在本研究中发现, 香豆素联合疫苗组在D14、D15显著高于单一灭活疫苗组和对照组。这与黄颡鱼在接种维氏气单胞菌和爱德华氏菌疫苗时的结果类似[25]。这说明香豆素具有提高鱼类免疫力的能力, 而香豆素联合疫苗对虹鳟感染IHNV有更强的保护效果。
4. 结论
本研究开发了基于中国甘肃分离的IHNV GS的单一灭活疫苗和香豆素组合疫苗, 两种疫苗显著增强了虹鳟的保护作用。本研究通过血清免疫酶活性的测定、组织病理切片观察及免疫基因相对表达量的变化评价了香豆素联合IHNV灭活疫苗对虹鳟的免疫保护效果。研究发现香豆素+疫苗组在攻毒后可有效减少虹鳟脾脏组织的病理损伤, 且相比于对照组和单一灭活疫苗炎症反应更轻微。香豆素+疫苗组的AKP、ACP、CAT等免疫酶活性相比于对照组和单一灭活疫苗显著升高。此外, 香豆素+疫苗组可强烈诱导MHC-I、MHC-II和IFN-γ等免疫相关基因的表达。这些结果表明, 香豆素提高灭活IHNV疫苗的免疫效力是可行的, 本研究结果将提供一种有前景的针对IHNV的候选疫苗。
-
表 1 RT-qPCR所用引物及其序列
Table 1 Primers and sequences used for RT-qPCR
引物名称
Primer上游引物序列
Primer sequence (5′—3′)下游引物序列
Reverse primer sequenceMX1 TCGGCAGAGAGGCTGTATTT TTGAGACGAACTCCGCTTTT IFN-γ GCCATGAAACCTGAGAGGAG TCTTTGCAGATGACGTTTCG MHC-I GACAGTCCGTCCTCAGTGT CTGGAAGGTTCCATCATCGT MHC-II TGCCATGCTGATGTGCAG GTCCCTCAGCCAGGTCACT CD4 CCTGCTCATCCACAGCCTAT CTTCTCCTGGCTGTCTGACC CD8 AGTCGTGCAAAGTGGGAAAG GGTTGCAATGGCATACAGTG C3 CACCCACCACCATACCAA GCTACGATGCGGAACGAC IGT AGCACCAGGGTGAAACC GCGGTGGGTTCAGAGTC VIG1 CTACAATCAAGGTGGTGAACAATGT GTGGAAACAAAAACCGCACTTATA -
[1] Kang B, Vitule J R S, Li S, et al. Introduction of non-native fish for aquaculture in China: a systematic review [J]. Reviews in Aquaculture, 2023, 15(2): 676-703. doi: 10.1111/raq.12751
[2] Everson J L, Jones D R, Taylor A K, et al. Aquaculture reuse water, genetic line, and vaccination affect rainbow trout (Oncorhynchus mykiss) disease susceptibility and infection dynamics [J]. Frontiers in Immunology, 2021, 12: 721048. doi: 10.3389/fimmu.2021.721048
[3] Xu L, Zhao J, Liu M, et al. Phylogeography and evolution of infectious hematopoietic necrosis virus in China [J]. Molecular Phylogenetics and Evolution, 2019, 131: 19-28. doi: 10.1016/j.ympev.2018.10.030
[4] Jia P, Breyta R B, Li Q, et al. Insight into infectious hematopoietic necrosis virus (IHNV) in Chinese rainbow trout aquaculture from virus isolated from 7 provinces in 2010–2014 [J]. Aquaculture, 2018, 496: 239-246. doi: 10.1016/j.aquaculture.2018.06.062
[5] Lapatra S E. Factors affecting pathogenicity of infectious hematopoietic necrosis virus (IHNV) for salmonid fish [J]. Journal of Aquatic Animal Health, 1998, 10(2): 121-131. doi: 10.1577/1548-8667(1998)010<0121:FAPOIH>2.0.CO;2
[6] Dixon P, Paley R, Alegria-Moran R, et al. Epidemiological characteristics of infectious hematopoietic necrosis virus (IHNV): a review [J]. Veterinary Research, 2016, 47(1): 1-26. doi: 10.1186/s13567-015-0288-7
[7] Xu L, Zhao J, Ren G, et al. Co-infection of infectious hematopoietic necrosis virus (IHNV) and infectious pancreatic necrosis virus (IPNV) caused high mortality in farmed rainbow trout (Oncorhynchus mykiss) in China [J]. Aquaculture, 2019, 512: 734286. doi: 10.1016/j.aquaculture.2019.734286
[8] Ferri G, Lauteri C, Vergara A. Antibiotic resistance in the finfish aquaculture industry: a review [J]. Antibiotics, 2022, 11(11): 1574. doi: 10.3390/antibiotics11111574
[9] Hossain A, Habibullah-Al-Mamun M, Nagano I, et al. Antibiotics, antibiotic-resistant bacteria, and resistance genes in aquaculture: risks, current concern, and future thinking [J]. Environmental Science and Pollution Research International, 2022, 29(8): 11054-11075. doi: 10.1007/s11356-021-17825-4
[10] Soltani M, Lymbery A, Song S K, et al. Adjuvant effects of medicinal herbs and probiotics for fish vaccines [J]. Reviews in Aquaculture, 2019, 11(4): 1325-1341. doi: 10.1111/raq.12295
[11] Sommerset I, Krossøy B, Biering E, et al. Vaccines for fish in aquaculture [J]. Expert Review of Vaccines, 2005, 4(1): 89-101. doi: 10.1586/14760584.4.1.89
[12] Wang Q, Ji W, Xu Z. Current use and development of fish vaccines in China [J]. Fish & Shellfish Immunology, 2020, 96: 223-234.
[13] Yamashita H, Fujita Y, Kawakami H, et al. The efficacy of inactivated virus vaccine against viral nervous necrosis (VNN) [J]. Fish Pathology, 2005, 40(1): 15-21. doi: 10.3147/jsfp.40.15
[14] Dharmaratnam A, Sudhagar A, Swaminathan T R. Evaluation of protective effects of heat-inactivated cyprinid herpesvirus-2 (CYhV-2) vaccine against herpesviral hematopoietic necrosis disease (HVHND) in goldfish (Carassius auratus) [J]. Fish & Shellfish Immunology, 2023, 132: 108460.
[15] Tafalla C, Bøgwald J, Dalmo R A. Adjuvants and immunostimulants in fish vaccines: current knowledge and future perspectives [J]. Fish & Shellfish Immunology, 2013, 35(6): 1740-1750.
[16] Huo X, Yan Y, Chang J, et al. Astragalus polysaccharide or β-glucan combined with inactivated vaccine markedly prevent CyHV-2 infection in Carassius auratus gibelio [J]. Aquaculture and Fisheries, 2024, 9(5): 763-775. doi: 10.1016/j.aaf.2022.12.004
[17] Hara K, Sato T, Katoh R, et al. Molecular design of coumarin dyes for efficient dye-sensitized solar cells [J]. The Journal of Physical Chemistry B, 2003, 107(2): 597-606. doi: 10.1021/jp026963x
[18] Peng X M, Lv Damu G L V, He Zhou C H. Current developments of coumarin compounds in medicinal chemistry [J]. Current Pharmaceutical Design, 2013, 19(21): 3884-3930. doi: 10.2174/1381612811319210013
[19] Sandmann L, Schulte B, Manns M P, et al. Treatment of chronic hepatitis C: efficacy, side effects and complications [J]. Visceral Medicine, 2019, 35(3): 161-170. doi: 10.1159/000500963
[20] Wang Y, Yan W, Chen Q, et al. Inhibition viral RNP and anti-inflammatory activity of coumarins against influenza virus [J]. Biomedicine & Pharmacotherapy, 2017, 87: 583-588.
[21] Gómez-Calderón C, Mesa-Castro C, Robledo S, et al. Antiviral effect of compounds derived from the seeds of Mammea americana and Tabernaemontana cymosa on Dengue and Chikungunya virus infections [J]. BMC Complementary and Alternative Medicine, 2017, 17(1): 57. doi: 10.1186/s12906-017-1562-1
[22] Hu Y, Shan L P, Liu H F, et al. Highly efficient inhibition of infectious hematopoietic necrosis virus replication mediated by a novel synthesized coumarin derivative in vitro and in vivo [J]. Aquaculture, 2021, 545: 737281. doi: 10.1016/j.aquaculture.2021.737281
[23] Hoyberghs J, Bars C, Ayuso M, et al. DMSO concentrations up to 1% are safe to be used in the zebrafish embryo developmental toxicity assay [J]. Frontiers in Toxicology, 2021, 3: 804033. doi: 10.3389/ftox.2021.804033
[24] Wu D, Shao S, Liu Q, et al. Protection of a CpG-adjuvanted DNA vaccine against infectious hematopoietic necrosis virus (IHNV) nature infection in rainbow trout (Oncorhynchus mykiss) [J]. Aquaculture, 2023, 572: 739555. doi: 10.1016/j.aquaculture.2023.739555
[25] Kong W G, Qin D C, Mu Q J, et al. Mucosal immune responses and protective efficacy in yellow catfish after immersion vaccination with bivalent inactivated Aeromonas veronii and Edwardsiella ictaluri vaccine [J]. Water Biology and Security, 2022, 1(2): 100032. doi: 10.1016/j.watbs.2022.100032
[26] Wang W, Wang W, Xu W, et al. Polyactin A and CpG enhance inactivated Pseudomonas plecoglossicida vaccine potency in large yellow croaker (Larimichthys crocea) [J]. Fish & Shellfish Immunology, 2022, 120: 133-138.
[27] Wang H, Hu Y, Song D W, et al. Synthesis and application of a potential therapeutic coumarin derivative against IHNV in aquaculture [J]. Aquaculture, 2021, 543: 736999. doi: 10.1016/j.aquaculture.2021.736999
[28] Zhang J, Fu X, Zhang Y, et al. Chitosan and anisodamine improve the immune efficacy of inactivated infectious spleen and kidney necrosis virus vaccine in Siniperca chuatsi [J]. Fish & Shellfish Immunology, 2019, 89: 52-60.
[29] Osman A G M, Koutb M, Sayed A E H. Use of hematological parameters to assess the efficiency of quince (Cydonia oblonga Miller) leaf extract in alleviation of the effect of ultraviolet–A radiation on African catfish Clarias gariepinus (Burchell, 1822) [J]. Journal of Photochemistry and Photobiology B: Biology, 2010, 99(1): 1-8. doi: 10.1016/j.jphotobiol.2010.01.002
[30] Zhu S, Miao Q, Chen Q, et al. Synthesis and antioxidant evaluation of coumarin-functionalised chitosan: a potent, non-toxic free radical scavenging compound [J]. Carbohydrate Research, 2025, 548: 109311. doi: 10.1016/j.carres.2024.109311
[31] 葛明峰, 徐胜威, 景宏丽, 等. 鲤春病毒血症的检测技术与防控研究进展[J]. 宁波大学学报, 2025, 38 (01): 100-106.] Ge M F, Xu S W, Jing H L, et al. Research progress on detection technology and prevention of spring Viremia in cyprinus carpio. [J]. Journai of Ningbo University, 2025, 38 (01): 100-106. [
[32] 贾凡. 四种免疫佐剂对豚鼠气单胞菌AC-CY株灭活疫苗免疫效果的影响 [D]. 长春: 吉林农业大学, 2023: 20-23.] Jia F, Effect of four kinds of immune adjuvants on immune effect of inactivated vaccine of Aeromonas caviae AC-CY strain [D]. Changchun: Jilin Agricultural University, 2023: 20-23. [
[33] 刘志鸿, 牟海津, 王清印. 软体动物免疫相关酶研究进展[J]. 海洋水产研究, 2003, 24 (3): 86-90. Liu Z, Mou H J, Wang Q Y, Research progress of immune related enzymes in mollusca[J]. Progress in Fishery Sciences, 2003, 24 (3): 86-90.
[34] Lee J C, Park J H, Ahn J H, et al. Effects of chronic scopolamine treatment on cognitive impairment and neurofilament expression in the mouse hippocampus [J]. Molecular Medicine Reports, 2018, 17(1): 1625-1632.
[35] Liu J, Zhang P, Wang B, et al. Evaluation of the effects of Astragalus polysaccharides as immunostimulants on the immune response of crucian carp and against SVCV in vitro and in vivo [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2022, 253 : 109249.
[36] Uddowla S, Freytag L C, Clements J D. Effect of adjuvants and route of immunizations on the immune response to recombinant plague antigens [J]. Vaccine, 2007, 25(47): 7984-7993. doi: 10.1016/j.vaccine.2007.09.030
[37] Zhu W, Zhang Y, Zhang J, et al. Astragalus polysaccharides, chitosan and poly (I: C) obviously enhance inactivated Edwardsiella ictaluri vaccine potency in yellow catfish Pelteobagrus fulvidraco [J]. Fish & Shellfish Immunology, 2019, 87: 379-385.
[38] Sarhan M A, Shihab S, Kashem B E, et al. New exact operational shifted pell matrices and their application in astrophysics [J]. Journal of Physics: Conference Series, 2021, 1879(2): 022122. doi: 10.1088/1742-6596/1879/2/022122
[39] Hsieh S L, Chen Y N, Kuo C M. Physiological responses, desaturase activity, and fatty acid composition in milkfish (Chanos chanos) under cold acclimation [J]. Aquaculture, 2003, 220(1/2/3/4): 903-918.
[40] Zhao Y L, Yang X W, Wu B F, et al. Anti-inflammatory effect of pomelo peel and its bioactive coumarins [J]. Journal of Agricultural and Food Chemistry, 2019, 67(32): 8810-8818. doi: 10.1021/acs.jafc.9b02511
[41] Xu L, Zhao J, Liu M, et al. A effective DNA vaccine against diverse genotype J infectious hematopoietic necrosis virus strains prevalent in China [J]. Vaccine, 2017, 35(18): 2420-2426. doi: 10.1016/j.vaccine.2017.03.047
[42] Aggad D, Mazel M, Boudinot P, et al. The two groups of zebrafish virus-induced interferons signal via distinct receptors with specific and shared chains [J]. The Journal of Immunology, 2009, 183(6): 3924-3931. doi: 10.4049/jimmunol.0901495
[43] Song D W, Liu L, Shan L P, et al. Therapeutic potential of phenylpropanoid-based small molecules as anti-SVCV agents in aquaculture [J]. Aquaculture, 2020, 526: 735349. doi: 10.1016/j.aquaculture.2020.735349
[44] Dash P, Yadav S K, Garg L C, et al. Post-challenge immune gene expression profiling in rohu, Labeo rohita vaccinated with modified adjuvant-basedohu aeromonas hydrophila outer membrane protein R formulation [J]. Veterinarski Arhiv, 2017, 87(5): 607-622. doi: 10.24099/vet.arhiv.160430
[45] Li S, Xie H, Yan Z, et al. Development of a live vector vaccine against infectious hematopoietic necrosis virus in rainbow trout [J]. Fish & Shellfish Immunology, 2019, 89: 516-524.
[46] Jaafar R M, Chettri J K, Dalsgaard I, et al. Effects of adjuvant Montanide™ ISA 763 A VG in rainbow trout injection vaccinated against Yersinia ruckeri [J]. Fish & Shellfish Immunology, 2015, 47(2): 797-806.
[47] Liu L, Qiu T-X, Song D-W, et al. Inhibition of a novel coumarin on an aquatic rhabdovirus by targeting the early stage of viral infection demonstrates potential application in aquaculture [J]. Antiviral Research, 2020, 174: 104672. doi: 10.1016/j.antiviral.2019.104672



 下载:
下载: