RAPESEED MEAL REPLACEMENT FOR FISHMEAL ON GROWTH PERFORMANCE, ANTIOXIDANT CAPACITY, AND INTESTINAL MORPHOLOGY OF PARAMISGURNUS DABRYANUS
-
摘要:
试验旨在探寻大鳞副泥鳅饲料配方中菜粕替代鱼粉的最佳比例。用菜粕替代饲料中不同比例0 (P0)、10% (P10)、20% (P20)、30% (P30)、40% (P40)、50% (P50)的鱼粉, 配制成菜粕含量分别为6.00%、8.50%、11.00%、13.50%、16.00%和18.50%的六种等能等氮饲料, 投喂平均初始体重(5.09±0.01) g的大鳞副泥鳅8周, 分析不同替代比例的菜粕对大鳞副泥鳅生长性能、抗氧化能力及肠道形态的影响。替代组(P10—P40)的增重率和特定生长率与对照组没有显著性差异(P>0.05), P50组则显著性下降(P<0.05); 随着菜粕替代比例的上升, 肠道过氧化氢酶CAT、超氧化物歧化酶SOD、总抗氧化能力T-AOC在各组间未见显著性差异(P>0.05), 与P10组相比, P50组的丙二醛MDA含量最高且显著性增加(P<0.05), P40组与P10组相比碱性磷酸酶AKP活性呈显著性增加(P<0.05); 随着菜粕替代比例的上升肝脏总蛋白TP、CAT、SOD活性均未见显著性差异(P>0.05), 与对照组P0相比, P20组、P30组和P50组的MDA含量未见显著性差异(P>0.05), P10组和P40组的MDA含量呈现显著性差异(P<0.05), 且P40组的MDA含量最低; 随着菜粕替代比例的上升肠道的形态结构受到损伤, 绒毛高度和隐窝深度逐渐减小, P50组的绒毛高度和隐窝深度达到最低(P<0.05), 肌层厚度逐渐增大。饲料采用40%的菜粕替代鱼粉比例不会影响大鳞副泥鳅的增重率和特定生长率, 但随着菜粕替代比例的上升对大鳞副泥鳅的抗氧化能力和肠道形态结构起到了负面影响。
Abstract:The purpose of this study was to determine the optimal proportion of rapeseed meal to replace fishmeal in the feed formula of Paramisgurnus dabryanus. Rapeseed meal was used to replace different proportions of 0 (P0), 10% (P10), 20% (P20), 30% (P30), 40% (P40), and 50% (P50), resulting in six experimental diets with equal nitrogen and energy. These diets with rapeseed meal content of 6.00%, 8.50%, 11.00%, 13.50%, 16.00%, and 18.50% were fed to Paramisgurnus dabryanus with an average initial weight of (5.09±0.01) g for 8 weeks. The effects of different alternative proportions of rapeseed meal on the growth performance, antioxidant capacity, and intestinal morphology of Paramisgurnus dabryanus were analyzed. The weight gain rate and specific growth rate of the replacement group (P10—P40) were not significantly different from the control group (P>0.05), while the P50 group showed a significantly decline (P<0.05). No significant differences were observed in the activity of intestinal CAT, SOD, and T-AOC among the groups (P>0.05). Compared with P10 group, the MDA content in P50 group was the highest and significantly increased (P<0.05), and the AKP activity was significantly higher in P40 and P10 groups (P<0.05). The activities of TP, CAT, and SOD in liver did not change significantly with the increase of rapeseed meal replacement ratio (P>0.05). Compared with P0 group, the MDA content in P20, P30, and P50 groups were not significantly different (P>0.05), but was significantly different from that in P10 and P40 groups (P<0.05), with the P40 group showing the lowest MDA content. With the increase of replacement ratio in rapeseed meal, the intestine morphological structure was damaged, the villus height and crypt depth gradually decreased, reaching their lowest values in the P50 group (P<0.05), while the thickness of the muscular layer gradually increased. In conclusion, replacing up to 40% of fishmeal with rapeseed meal did not affect the weight gain rate and specific growth rate of Paramisgurnus dabryanus, however, higher replacement ratios had a negative impact on the antioxidant capacity and intestinal morphological structure.
-
随着国际形势和中美贸易的不断变化, 豆粕和鱼粉价格和供应的大幅度波动, 国内优质蛋白饲料的供需矛盾日渐紧张, 优质蛋白饲料被“卡脖子”的现象严重影响了水产和畜牧养殖业的稳定发展。为了能够摆脱“卡脖子”现象, 深入探究其他蛋白源饲料替代豆粕和鱼粉的高效利用是我国饲料和水产养殖行业健康发展的必经之路。
鱼粉和豆粕是水产养殖动物的优质蛋白来源, 但由于价格的居高不下, 国内一些养殖鱼类的饲料配方中已经利用棉粕、菜粕及其他杂粕大比例替代部分鱼粉和豆粕。棉粕粗蛋白含量约为41.7%, 粗脂肪约1.8%, 通常含有400—800 mg/kg的游离棉酚, 对水生动物具有毒性作用。油菜在国内有着大量的种植面积且菜粕市场价格较为稳定, 有效利用菜粕能够为解决“卡脖子”现象做出贡献。菜粕有着蛋白质含量高和消化率高的优点, 虽然有着硫甙、植酸、单宁、芥子碱及粗纤维等抗营养因子[1], 但已有大量实验证实, 菜粕的合理使用是安全可行。目前, 已在异育银鲫[2]、克原氏螯虾[3]、凡纳滨对虾[4]、黄颡鱼[5]、翘嘴鳜[6]、虹鳟[7]、暗纹东方鲀及草鱼[8]等进行了菜粕的研究, 菜粕相关试验尚未在大鳞副泥鳅中有所开展。
大鳞副泥鳅(Paramisgurnus dabryanus)是一种常见的底栖小型鱼类, 隶属于鲤形目、鳅科、副泥鳅属, 具有养殖周期短、环境适应能力强、有一定耐盐碱特性等特点, 是我国重要的名优经济养殖鱼类[9—11]。目前, 国内外对大鳞副泥鳅饲料蛋白源替代的研究相对较少。大鳞副泥鳅饲料中鱼粉和豆粕供给量被限制的现象, 严重制约了大鳞副泥鳅的集约化养殖的规模和大鳞副泥鳅饲料人工配合饲料的进一步发展。本研究旨在利用植物蛋白源菜粕替代部分鱼粉, 探究在不影响大鳞副泥鳅生长性能情况下大鳞副泥鳅饲料中菜粕替代鱼粉的适宜比例, 以期为大鳞副泥鳅不同蛋白源替代的研究提供一定依据。
1. 材料与方法
1.1 试验设计
试验共设计6组饲料, 对照组是含有25%鱼粉(CP70%)、6%菜粕(CP38.6%)的饲料、处理组分别添加2.5%、5%、7.5%、10%、12.5%的菜粕, 分别等量替代饲料中的鱼粉, 各实验组补加赖氨酸和蛋氨酸与对照组一致, 利用酪蛋白配平含氮量和能量, 配制成6种等氮等能试验饲料, 分别命名为P0(对照组)、P10、P20、P30、P40、P50。试验原料经粉碎后过80目筛, 再逐级混合、制粒膨化成1 mm粒径的颗粒饲料(表 1)。
表 1 试验饲料配方及主要营养物质(% 干物质基础)Table 1. Ingredient and proximate compositions of the experimental diets (% dry matter)原料Ingredient 菜粕替代水平比例Proportion of rapeseed meal substitution level 0 10% 20% 30% 40% 50% 鱼粉Fish meal 25.00 22.50 20.00 17.50 15.00 12.50 豆粕Soybean meal 20.00 20.00 20.00 20.00 20.00 20.00 菜粕Rapeseed meal 6.00 8.50 11.00 13.50 16.00 18.50 小麦粉Wheat starch 24.00 24.00 24.00 24.00 24.00 24.00 鱼油Fish oil 2.50 2.50 2.50 2.50 2.50 2.50 豆油Sopybean oil 2.50 2.50 2.50 2.50 2.50 2.50 60%胆碱60% Choline 0.40 0.40 0.40 0.40 0.40 0.40 酪蛋白Casein 0.12 1.00 1.89 2.78 3.66 4.54 大豆浓缩蛋白Soybean protein concentrate 10.00 10.00 10.00 10.00 10.00 10.00 大豆卵磷脂Soybean lecithin 1.00 1.00 1.00 1.00 1.00 1.00 磷酸二氢钙 Ca(H2PO4)2 2.00 2.00 2.00 2.00 2.00 2.00 赖氨酸 Lys 0.00 0.03 0.05 0.07 0.10 0.12 蛋氨酸 Met 0.00 0.01 0.01 0.01 0.01 0.01 微晶纤维素Microcrystalline cellulose 5.48 4.56 3.65 2.74 1.83 0.93 预混料Vitamin and mineral premix1 1.00 1.00 1.00 1.00 1.00 1.00 合计Total 100.00 100.00 100.00 100.00 100.00 100.00 营养水平Proximate composition2 (%) 粗蛋白Crude protein 36.38 36.55 36.68 36.26 36.33 36.50 粗脂肪Crude fat 6.99 6.78 7.10 6.87 7.00 7.11 粗灰分Ash 8.03 7.92 7.74 7.50 7.44 7.57 总能Gross energy (kJ/g) 17.04 17.08 17.13 17.17 17.21 17.25 注: 1预混料为每千克饲料提供: VA 5000 IU; VB1 25 mg; VB2 45 mg; VB6 20 mg; VB12 0.1 mg; VK3 10 mg; VE 200 mg; VC 200 mg; VD3 2500 IU; 肌醇200 mg; 泛酸60 mg; 烟酸200 mg; 叶酸10 mg; 生物素1.5 mg; NaSeO3·5H2O 0.3 mg; CoCl2·6H2O 0.4 mg; KI 0.8 mg; CuSO4·5H2O 10 mg; MnSO4·4H2O 20 mg; ZnSO4·H2O 50 mg; FeSO4·7H2O 150 mg; MgSO4·7H2O 500 mg; NaCl 1 000 mg; 2营养水平为实测值1The premix provided the followings per kg of diet: VA 5000 IU; VB1 25 mg; VB2 45 mg; VB6 20 mg; VB12 0.1 mg; VK3 10 mg; VE 200 mg; VC 200 mg; VD3 2500 IU; inositol 200 mg; pantothenic acid 60 mg; nicotinic acid 200 mg; folic acid 10 mg; biotin 1.5 mg; NaSeO3·5H2O 0.3 mg; CoCl2·6H2O 0.4 mg; KI 0.8 mg; CuSO4·5H2O 10 mg; MnSO4·4H2O 20 mg; ZnSO4·H2O 50 mg; FeSO4·7H2O 150 mg; MgSO4·7H2O 500 mg; NaCl 1 000 mg; 2Nutrient levels were measured values 1.2 试验鱼及日常管理
大鳞副泥鳅购买于高安, 并且选择健康状况良好的幼鱼。试验开始前暂养幼鱼2周, 期间投喂泥鳅商品饲料进行定时定量定点饲喂驯化, 早晚各投喂一次(8:00和17:00)。试验开始前停喂24h, 随后挑选出体质健壮、体表无伤、规格一致、初始体重在(5.09±0.01) g的大鳞副泥鳅共1440尾。对试验鱼随机分组, 共设置6个组, 每组4个重复, 每个重复60尾大鳞副泥鳅。试验采用规格为80 cm×66 cm×64 cm的养殖桶。每个桶的水体都进行24h不间断增氧, 并对养殖水体定期换水, 养殖用水为提前曝气的自来水。试验期间每天定时(8:00和17:00)投喂, 每天观察水温变化并记录, 同时观察试验对象的摄食情况和死亡情况。试验周期为8周。养殖期间水温24—30℃, pH在6.8左右, 溶解氧含量大于5.0 mg/L。
1.3 样品采集及指标检测
生长指标 在试验结束后, 禁食试验鱼24h后称重, 取桶内所有大鳞副泥鳅计数并称总重。每个桶随机选取10尾接近平均体重的试验鱼, 用MS-222麻醉后, 测量体重、体长和肝重, 计算增重率(WGR)、特定生长率(SGR)、饲料效率(FCR)、脏体指数(VSI)、肥满度(CF)、蛋白质效率(PER)和营养沉积率。
增重率(Weight gain rate, WGR, %)=100×(终末均体重–初始均体重)/初始均体重
特定生长率(Specific growth rate, SGR, %/d)=100×(ln末均体重–ln初均体重)/饲喂时间
饲料系数(Feed conversion ratio, FCR)=摄入干饲料的量/(终末鱼体体重−初始鱼体体重)
脏体指数(Viscerosomatic index, VSI)=100×内脏质量/体质量
肥满度(Condition factor, CF, g/cm3)=100×体重/体长3
蛋白质效率(Protein efficiency ratio, PER) = (终末体重-初始体重)/蛋白质摄入量
营养素沉积率(Nutrition deposit ratio)=(最终鱼体营养素含量-初始鱼体营养素含量)/采食的营养素量(营养包括蛋白质、脂肪)
全鱼营养成分 鱼体水分的测定采用105℃烘箱干燥恒重法(GB/T 6435-86), 粗蛋白的测定采用凯氏定氮法(GB/T 6432-94), 粗脂肪的测定采取索氏抽提法(GB/T 6433-94), 粗灰分采用550℃灼烧法(GB/T 6438-92)测定(AOAC, 1995)。
血清指标测定 试验鱼用MS-222麻醉后, 取10尾鱼的血液于无酶管中, 用于测定血清指标。使用试剂盒测定血清中的血清葡萄糖(Glucose, GLU)、白蛋白(Albumin, ALB)、甘油三酯(Triglyceride, TG)、尿素氮(Urea nitrogen, BUN), 所用试剂盒由南京建成生物工程研究所提供; 补体3 (Complement 3, C3)、补体4 (Complement 4, C4)和溶菌酶(LZM)采用酶联免疫吸附试验试剂盒测定, 所用试剂盒由上海优选生物科技有限公司提供。
肠道指标测定 试验鱼用MS-222麻醉后, 解剖泥鳅, 取3尾鱼的肠道立即液氮速冻, 肠道组织用于测定生化指标、抗氧化能力。商用试剂盒由南京建成生物工程研宄所提供, 试剂盒产品型号如下: 丙二醛(MDA)测定试剂盒(比色法; A003-1-2), 超氧化物歧化酶(SOD)测定试剂盒(WST-1法; A001-3-2), 过氧化氢酶(CAT)测定试剂盒(紫外法; A007-2-1); 总抗氧化能力(T-AOC)检测试剂盒(ABTS法; A15-2-1), 碱性磷酸酶(AKP)测定试剂盒(微板法; A059-2-2), 天门冬氨酸氨基转移酶 (谷草转氨酶/AST/GOT))测试盒 (微板法; C010-2-1), 丙氨酸氨基转移酶 (谷丙转氨酶/ALT/GPT) 测试盒 (赖氏法)微板法(C009-21)。
肝脏指标测定 试验鱼用MS-222麻醉后, 解剖泥鳅, 取3尾鱼的肝脏立即液氮速冻, 于–80℃冰箱保存备用。肝脏组织样品用于测定生化指标、抗氧化能力。测定指标与方法见肠道指标测定。
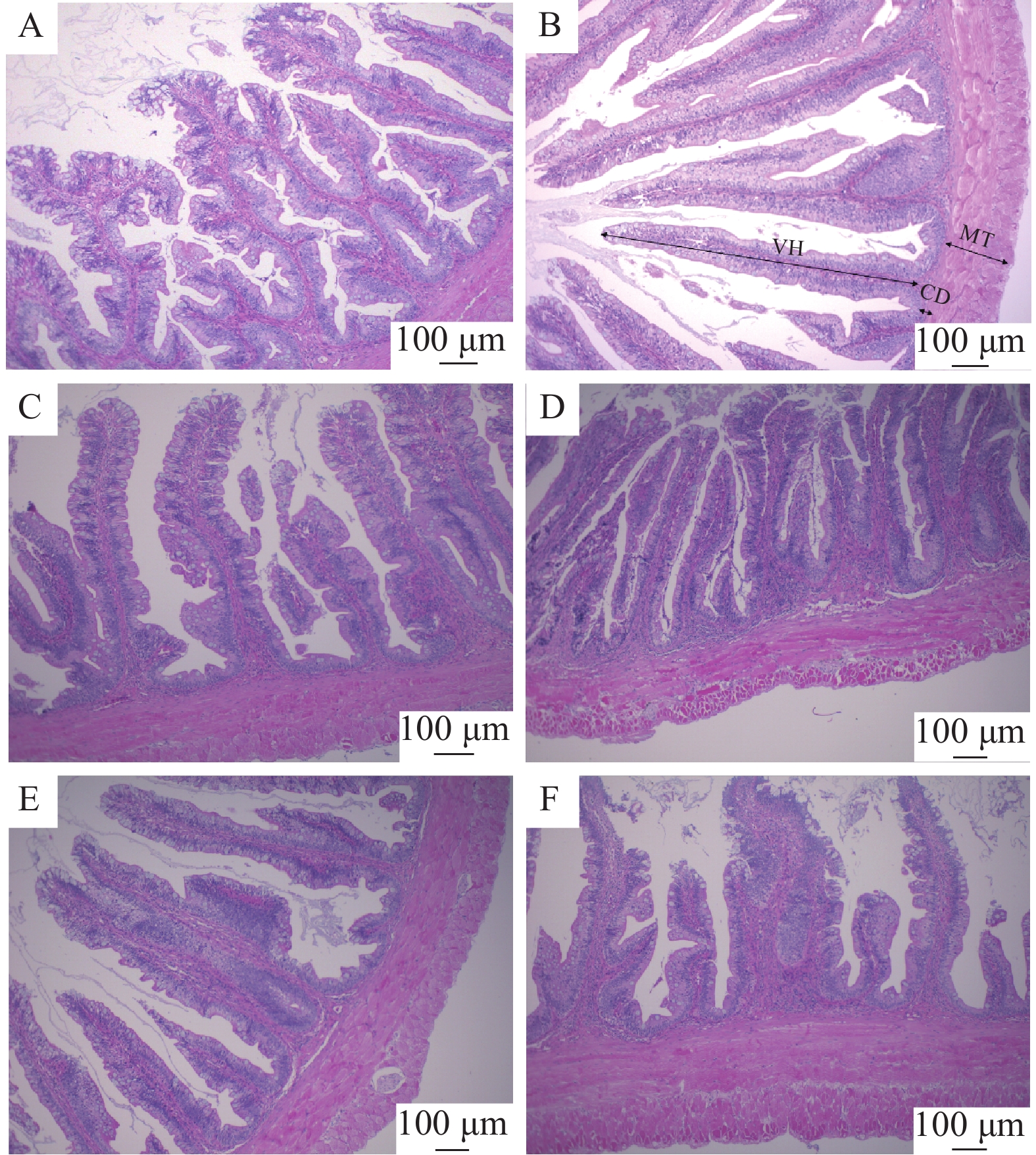
肠道组织结构形态 试验鱼麻醉后采集2尾鱼的前肠, 采集的肠道样品在固定后用于制作石蜡切片, 切片厚度为6 μm, 并进行HE染色观察分析。每组肠道样品观察3张不连续切片, 每张切片测量6根完整平直绒毛的高度和6处隐窝的深度、测定6处肌肉层的厚度, 最后以每样本的平均值作为测定数据统计分析。
1.4 统计方法
试验数据采用SPSS25.0软件进行单因素方差分析(One-way ANOVA), 以平均值及其相应的标准误表示(mean±SE), 并作Duncan’s多重比较, P<0.05表示差异显著。
2. 结果
2.1 生长性能
由表 2可知, 与对照组P0相比, P10的增重率和特定生长率都有所增加(P<0.05), P20、P30、P40、P50的增重率和特定生长率都随菜粕替代含量的上升呈现下降趋势(P<0.05); 与对照组P0相比, P10、P30和P40的蛋白质效率未表现出显著性差异, P50则呈显著性下降(P<0.05); 与对照组P0相比, 随着菜粕替代含量的上升未见各组肥满度呈显著性差异; 与对照组P0相比, 随着菜粕替代含量的上升蛋白质沉积率和脂肪沉积率都呈下降趋势, P10、P20、P30和P40的蛋白质沉积率和脂肪沉积率未表现出显著性差异, P50的蛋白质沉积率和脂肪沉积率则呈显著性下降(P<0.05)。
表 2 菜粕替代鱼粉对大鳞副泥鳅生长性能的影响Table 2. Effects of rapeseed meal instead of fishmeal on the growth performance of Paramisgurnus dabryanus指标 Index P0 P10 P20 P30 P40 P50 初重IBW (g) 5.12±0.02 5.06±0.04 5.12±0.03 5.05±0.01 5.07±0.04 5.06±0.04 末重FBW(g) 14.21±0.46a 14.25±0.11a 13.65±0.24a 13.79±0.19a 14.17±0.22a 12.74±0.27b 增重率WGR (%) 177.06±10.22a 182.05±2.19a 163.79±4.17a 176.10±5.43ab 175.01±4.51a 144.32±9.47b 特定生长率SGR (%) 1.70±0.06a 1.73±0.01a 1.62±0.03a 1.69±0.03a 1.68±0.03a 1.49±0.07b 饲料系数FCR 1.59±0.13ab 1.56±0.04b 2.00±0.24a 1.73±0.06a 1.70±0.02ab 2.03±0.11ab 肥满度CF (g/cm3) 0.93±0.03ab 0.88±0.01ab 0.94±0.01a 0.90±0.02ab 0.90±0.01b 0.93±0.01ab 蛋白质效率PER 1.75±0.22a 1.76±0.08a 1.42±0.28b 1.60±0.12ab 1.62±0.03ab 1.37±0.15b 蛋白沉积率PDR (%) 0.28±0.02a 0.26±0.01ab 0.22±0.02abc 0.23±0.01abc 0.24±0.00abc 0.21±0.01c 脂肪沉积率FDR (%) 0.60±0.04ab 0.67±0.01b 0.53±0.04ab 0.61±0.01 ab 0.62±0.00ab 0.54±0.04b 注: 蛋白沉积率和脂肪沉积率计算使用湿物质基础下的粗蛋白和粗脂肪占比; 同一行相同右上角含有相同英文上标字母或无上标表示无显著差异(P<0.05); 下同Note: The PDR and FDR are calculated as the proportion of crude protein and crude lipid on a wet material basis; In the same row, values with superscript letter or no superscript indicate significantly difference (P<0.05); the same applies below 2.2 全鱼的营养成分
由表 3可知, 与对照组P0相比, 随着菜粕替代鱼粉含量的增加, 粗脂肪的比例呈上升趋势, P40时粗脂肪含量最高; 与对照组P0相比, P10、P30和P40的粗灰分含量未表现出显著性差异, P50的粗灰分含量呈显著性下降(P<0.05); 与对照组P0相比, P10的粗蛋白含量表现出显著性下降, P20、P40和P50未表现出显著性差异(P<0.05)。
表 3 菜粕替代鱼粉对大鳞副泥鳅全鱼营养成分的影响 (%干物质基础)Table 3. Effects of rapeseed meal instead of fishmeal on whole body composition of Paramisgurnus dabryanus (% dry basic)成分Ingredient P0 P10 P20 P30 P40 P50 水分Moisture 73.15±0.19 72.87±1.26 73.13±0.36 73.87±0.09 73.18±0.67 72.71±0.42 粗蛋白Crude protein 60.39±0.54a 56.65±1.27b 59.38±0.71ab 57.24±0.54b 57.78±0.06ab 57.46±0.32ab 粗脂肪Crude lipid 20.27±0.26b 21.18±0.22ab 21.16±0.49ab 22.15±0.83a 22.18±0.16a 21.45±0.88ab 粗灰分Ash 9.79±0.34abc 9.86±0.07ab 9.13±0.10bc 10.06±0.18a 9.75±0.41abc 8.98±0.25c 2.3 菜粕替代鱼粉对大鳞副泥鳅血清生化指标的影响
由表 4可知, 血清中TG、Alb和C4未随菜粕替代比例的上升而呈现显著性差异(P>0.05); 与对照组P0相比, P10和P20的GLU含量未表现出显著性差异, P30和P40的GLU含量呈现显著性增加, P50的GLU含量表现为极显著增加, 随菜粕替代鱼粉比例的增加, GLU的含量呈现上升趋势, 在P50时GLU含量达到最高值(P<0.05); 与对照组P0相比, P10、P30、P40和P50的BUN含量未表现出显著性差异, P20的BUN呈现出显著性增加(P<0.05); 与对照组P0相比, P10和P50的C3含量呈现极显著增加, P30的C3含量表现为显著性增加, P20和P40的C3含量未表现出显著性差异, 随着菜粕替代比例的增加, 大鳞副泥鳅的C3含量整体呈上升趋势(P<0.05); 与对照组P0相比, P50的LZM活性表现为显著性差异, P10、P20、P30和P40的LZM未呈现出显著性差异, P0时LZM的含量最低(P<0.05)。
表 4 菜粕替代鱼粉对大鳞副泥鳅血清生化指标的影响Table 4. Effects of rapeseed meal instead of fishmeal on serum biochemical indexes of Paramisgurnus dabryanus指标Index P0 P10 P20 P30 P40 P50 甘油三酯TG (mmol/L) 2.34±0.09 3.09±0.13 3.12±0.42 2.97±0.36 3.27±0.45 2.66±0.38 白蛋白Alb (g/L) 1.30±0.25 1.04±0.02 0.97±0.01 1.02±0.06 1.00±0.01 1.04±0.06 葡萄糖GLU (mmol/L) 3.70±0.18c 4.29±0.22bc 4.26±0.55bc 4.64±0.21ab 4.83±0.12ab 5.36±0.19a 血尿素氮BUN (mmol/L) 50.77±1.87b 53.55±1.49b 64.80±1.89a 52.58±2.31b 54.73±4.66b 54.00±1.32b 补体3 C3 (U/L) 393.95±25.65abc 423.90±5.85a 363.92±6.31c 420.90±5.41ab 379.22±3.57bc 425.68±15.77a 补体4 C4 (U/L) 305.72±21.82 316.83±5.78 321.33±10.30 309.65±8.45 327.83±6.17 328.50±7.15 溶菌酶LZM (U/L) 13.25±0.38a 13.03±0.52ab 13.55±0.68a 13.05±0.32ab 13.15±0.33ab 11.75±0.28b 2.4 菜粕替代鱼粉对大鳞副泥鳅肠道消化酶的影响
由表 5可知, 与对照组P0相比, P20、P30、P40和P50的脂肪酶酶活性未呈显著性差异, P10的淀粉酶活性呈显著性升高(P<0.05); 与对照组P0相比, P20、P30、P40和P50的淀粉酶活性未呈显著性差异, P10的淀粉酶活性呈显著性下降, 随着菜粕替代比例的上升, 淀粉酶活性呈上升趋势(P<0.05); 与对照组相比, P10、P20、P30和P40的胰蛋白酶活性未表现出显著性差异, P50的胰蛋白酶活性呈现显著性上升, 整体胰蛋白酶活性随菜粕替代比例的上升表现出上升趋势(P<0.05)。
表 5 菜粕替代鱼粉对大鳞副泥鳅消化酶活性的影响Table 5. Effects of rapeseed meal instead of fishmeal on digestive enzyme activity of Paramisgurnus dabryanus (U/mgprot)消化酶Digestive enzyme P0 P10 P20 P30 P40 P50 脂肪酶LPS 1.31±0.14b 2.49±0.26a 1.64±0.11b 1.91±0.20ab 1.77±0.21b 1.82±0.21b 淀粉酶AMS 1.28±0.24ab 0.57±0.15b 0.99±0.15ab 1.56±0.28a 1.44±0.47ab 1.87±0.28a 胰蛋白酶Trypsin 4836.87±189.00bc 4751.95±176.82bc 4957.16±128.76abc 4507.49±123.04c 5258.53±148.55ab 5452.12±220.94a 2.5 菜粕替代鱼粉对大鳞副泥鳅肠道生化指标、抗氧化指标的影响
由表 6可知, 肠道TP、CAT、SOD的活性不随菜粕替代鱼粉含量的变化而表现出显著性差异; 与对照组P0相比, P10、P20、P30和P50的T-AOC的活性不随菜粕替代鱼粉的含量的变化表现出显著性差异, P40呈现显著性下降(P<0.05); 随着菜粕替代鱼粉比例的上升, MDA的活性也呈现上升趋势, 与P10相比, P50的MDA含量显著性增加(P<0.05); P10与对照组P0的AKP活性未见显著性差异, P40与P10相比AKP活性呈显著性增加, 随着菜粕替代含量的上升, AKP的含量也呈现上升趋势(P<0.05)。
表 6 菜粕替代鱼粉对大鳞副泥鳅肠道生化指标、抗氧化能力的影响Table 6. Effects of substitution of fishmeal with rapeseed meal on intestinal biochemical indices and antioxidant capacity of Paramisgurnus dabryanus指标Index P0 P10 P20 P30 P40 P50 总蛋白TP (μg/mL) 962.95±32.73 994.44±29.45 971.57±34.50 898.81±20.46 870.82±101.43 867.59±15.18 过氧化氢酶CAT (U/gprot) 4.04±0.39 4.13±0.12 3.43±0.26 3.91±0.45 4.32±0.18 4.33±0.13 超氧化物歧化酶SOD (U/mgprot) 25.94±2.33 30.68±1.96 29.47±1.34 27.28±0.20 33.31±3.94 26.83±1.96 总抗氧化能力T-AOC (mM) 0.31±0.04a 0.38±0.03a 0.40±0.00a 0.30±0.00a 0.18±0.02b 0.34±0.06a 丙二醛MDA (nmol/mgprot) 5.90±0.38ab 5.08±0.26b 4.94±0.07b 6.70±0.18ab 6.46±0.82ab 7.38±1.31a 碱性磷酸酶AKP (金氏单位/g) 7.88±0.08b 7.23±1.37b 9.41±0.41ab 11.26±2.41ab 13.99±1.77a 9.93±1.55ab 2.6 菜粕替代鱼粉对大鳞副泥鳅肝脏生化指标、抗氧化指标的影响
由表 7可知, 肝脏CAT和T-AOC的活性不随菜粕替代鱼粉比例的改变而呈现显著性差异(P>0.05); 与对照组P0相比, P10、P20、P30、P40和P50的SOD活性都呈现显著性差异(P<0.05), P30的SOD含量达到最高; 与对照组P0相比, P50的GOT活性呈极显著差异, P20、P30和P40的GOT活性呈现显著性差异, P10的GOT活性未见显著性差异, 随着菜粕替代比例的上升, GOT活性也呈上升趋势, P50时GOT活性达到最高(P<0.05); 与对照组P0相比, 各试验组的GPT活性均表现出显著性下降, 各试验组间相比较, P10时GPT活性最低, P40时GPT活性最高(P<0.05); 与对照组P0相比, 除P10外各实验组MDA含量未见显著性差异, P10的MDA含量呈现显著性下降(P<0.05)。
表 7 菜粕替代鱼粉对大鳞副泥鳅肝脏生化指标、抗氧化能力的影响Table 7. Effects of substitution of fishmeal with rapeseed meal on liver biochemical indices and antioxidant capacity of Paramisgurnus dabryanus指标Index P0 P10 P20 P30 P40 P50 过氧化氢酶CAT (U/gprot) 31.83±3.53 35.22±2.22 32.26±1.03 36.41±2.06 32.29±0.86 35.96±2.12 超氧化物歧化酶SOD (U/mgprot) 35.98±3.51a 25.32±0.38b 22.25±2.27b 27.16±2.71b 20.06±1.20b 24.33±4.20b 谷草转氨酶GOT (U/gprot) 12.40±0.57c 14.80±1.18c 21.26±0.32b 18.81±2.02b 20.07±0.57b 43.42±1.78a 谷丙转氨酶GPT (U/gprot) 3.83±0.27a 1.33±0.18b 1.77±0.01b 1.35±0.57b 2.14±0.53b 1.81±0.46b 总抗氧化能力T-AOC (mM) 0.29±0.02 0.17±0.02 0.14±0.03 0.25±0.06 0.22±0.09 0.14±0.02 丙二醛MDA (nmol/mgprot) 1.51±0.08ab 1.31±0.01b 1.49±0.05ab 1.65±0.08ab 1.65±0.24ab 1.69±0.04a 2.7 菜粕替代鱼粉对大鳞副泥鳅肠道的形态学影响
各组处理后的大鳞副泥鳅肠道组织切片见图 1, 各部分测量数据见表 8。由表 8可知, 不同菜粕替代水平替代鱼粉后对肠道组织形态学产生不一样的影响。与对照组P0相比, 随着菜粕替代比例的逐渐增加, 绒毛高度逐渐降低, 绒毛密度和绒毛宽度逐渐变小; P50相比于P0的绒毛脱落和破损程度更加剧烈。由表 8可知, 与对照组P0相比, P10的绒毛高度显著增加, P20、P30、P40的绒毛高度无显著性差异, P50与P10相比, P50的绒毛高度显著减少, 随着菜粕替代比例的不断增加, 大鳞副泥鳅的肠道绒毛高度逐渐降低, P50时绒毛高度达到最低(P<0.05); 与对照组P0相比, P20、P30和P40的隐窝深度无显著性差异, P10和P50的隐窝深度都呈显著性减少, 当菜粕替代比例达到50%时, 大鳞副泥鳅肠道的隐窝深度最低(P<0.05); 与对照组P0相比, P20的肌层厚度呈显著性增加, P10、P30、P40和0P50的肌层厚度无显著性差异(P<0.05); 与对照组P0相比, P20、P30、P40和P50绒毛高度和隐窝深度的比值未呈显著性差异, P10的绒毛高度和隐窝深度的比值呈显著性增加且比值最高(P<0.05)。
表 8 菜粕替代鱼粉对大鳞副泥鳅肠道形态学的影响Table 8. Effects of rapeseed meal instead of fishmeal on intestinal morphology of Paramisgurnus dabryanus指标Index P0 P10 P20 P30 P40 P50 绒毛高度Villus height (um) 626.49±77.26ab 737.44±90.28a 620.46±9.93a 570.27±76.65ab 616.72±26.65ab 487.08±29.47b 隐窝深度Crypt depth (um) 42.88±3.83a 31.00±2.82b 44.82±3.15a 37.97±4.44b 37.61±3.96ab 26.86±2.53b 肌层厚度Muscle thickness (um) 178.35±10.20b 192.43±15.53b 260.65±13.97a 228.28±1.75ab 203.92±14.27b 229.89±27.17ab 绒毛高度/隐窝深度V/C 14.69±1.52b 20.44±0.83a 13.26±0.34b 16.73±1.29ab 16.90±2.40ab 16.35±1.55ab 3. 讨论
3.1 菜粕替代鱼粉对大鳞副泥鳅生长性能和全鱼营养成分的影响
菜粕是一种营养比较丰富全面的饲用蛋白源, 依据不同的加工工艺有着不同的营养水平, 粗蛋白在35%—45%, 其中可消化蛋白含量在90%—91%[12, 13]。由于鱼粉和豆粕在饲料配方中受到一定限制, 菜粕这一合适的植物蛋白源常用来替代部分鱼粉和豆粕来降低饲料的成本, 弥补鱼粉和豆粕供给量不足导致的蛋白质含量不能满足养殖对象生长需求的现象。本试验中菜粕替代部分鱼粉对大鳞副泥鳅增重率、特定生长率、肥满度和全鱼营养成分等均有影响。随着菜粕替代鱼粉比例的增加, 大鳞副泥鳅的增重率随之降低, 且菜粕替代鱼粉的比例在50%时, 平均增长率最低。替代比例在10%—50%, 特定生长率呈现先上升后下降的趋势, 这一现象可能是由于饲料中鱼粉与菜粕相应减少和增加, 使饲料中氨基酸更加平衡, 且必需氨基酸的平衡水平得到提高, 有利于鱼体的吸收与利用。当菜粕替代鱼粉比例在40%时, 大鳞副泥鳅的粗脂肪含量最高; 10%替代比例时, 粗蛋白含量最低且与对照组呈显著性差异; 50%替代比例时, 粗灰分含量最低。究其原因, 大鳞副泥鳅随着菜粕替代水平的改变, 生长性能和全鱼营养成分方面出现的各种影响, 都与菜粕本身的营养组成有一定联系。菜粕本身所含赖氨酸含量相对较低, 含硫氨基酸水平较高, 但其氨基酸利用率和蛋白质消化率都低于豆粕[14, 15]。鱼粉所具有的必需氨基酸和脂肪酸含量高、抗营养因子少且易被鱼体消化吸收, 而菜粕含有多种毒素和抗营养因子, 如硫甙、植酸、单宁、芥子酸、芥子碱及粗纤维等[16, 17]。随着菜粕替代鱼粉比例以及养殖周期的不断增加, 养殖对象体内的有害物质的含量逐渐增加, 会对大鳞副泥鳅的生长性能产生不利影响[16]。杨耐德等[18]经实验得出替代鱼粉比例的增加会降低对虾的生长性能和饲料利用率; 高贵琴等[19]发现菜粕高比例替代鱼粉会对异育银鲫(Carassiu sauratu sgibelio)和团头鲂(Megalobrama amblycephola)生长产生影响; 林仕梅等[20]发现配方中菜粕和棉粕的总量达到52%以上时会抑制罗非鱼的生长。本试验发现, 当菜粕替代比例在50%时, 鱼粉的含量已经低于15%, 对大鳞副泥鳅的增重率有显著影响, 这一结果与张恒等[16]发现当菜籽粕替代比例达到50%时, 鱼粉含量已低于22%, 凡纳滨对虾生长性能受到显著影响的结果相似。Davies等[21]研究发现, 饲料中15%菜粕替代FM/SBM, 不会影响莫桑比克罗非鱼的生长, 本试验发现, 菜粕替代鱼粉比例在10%—40%时, 大鳞副泥鳅的特定生长率不会出现显著性差异。
3.2 菜粕替代鱼粉对大鳞副泥鳅血清生化指标的影响
鱼体的健康、营养和疾病等状况与血清蛋白成分及其含量变化有着密不可分的联系, 因此血清蛋白的含量变化能够间接反映机体生理或病理上的变化。肝是合成白蛋白的唯一场所, 血清白蛋白的降低与肝功能受损有着一定关系。尿素氮的含量衡量动物体内蛋白质代谢和氨基酸平衡的一个重要指标, 肝肾功能出问题时血中尿素氮浓度升高[22, 23]。补体激活后具有免疫调节、介导炎症反应和免疫复合物溶解等重要生物学效应, C3和C4是补体系统的主要成分, 鱼类的C3具有比哺乳动物较多的活性形式[24]。本试验结果显示, TG、Alb和C4含量与对照组无显著性差异。这一结果与黄云等[17]发现双低菜粕不影响青鱼幼鱼补体C4 含量和马利等[22]发现不同菜粕水平不会导致草鱼血清种白蛋白含量变化结果一致。血清中葡萄糖含量的保持相对稳定对机体维持机体健康有影响, 本试验结果显示, 10%和20%的菜粕替代比例不会对大鳞副泥鳅的血糖产生影响, 30%—50%时会导致机体血糖浓度显著性增大, 这一结果与马利等[22]结果不一致。这一现象可能是菜粕中抗营养因子对大鳞副泥鳅肝脏造成损伤, 使肝脏不能正常进行糖代谢, 机体血液中增加的葡萄糖得不到抑制, 从而使血糖升高[25]。此外, 血清中尿素氮含量除20%替代组外都与对照组无显著性差异, 这与易军等[26]在肥牛中发现菜粕不会影响血清尿素氮含量的结果类似。本试验中发现血清中溶菌酶仅50%替代比例时与对照组呈现显著性下降, 这与黄云等[17]的类似。
3.3 菜粕替代鱼粉对大鳞副泥鳅肠道消化酶的影响
大鳞副泥鳅通过肠道进行消化吸收外界营养物质, 而肠道的消化酶活性的高低直接决定了大鳞副泥鳅对饲料中营养物质的吸收效率, 同时也对大鳞副泥鳅生长发育快慢的重要影响[11, 27]。饵料作为对消化酶活性的高低有着主要影响的外源因素, 添加高比例菜粕势必会对大鳞副泥鳅的消化能力起到一定影响[28]。本试验结果表明, 随着饲料中菜粕替代鱼粉的比例的升高, 大鳞副泥鳅肠道中脂肪酶、淀粉酶和胰蛋白酶活性均呈现升高趋势, 脂肪酶在10%替代组达到最高组, 但10%和30%替代组无显著差异, 这在一定程度上表明适当比例的菜粕替代鱼粉可以提高大鳞副泥鳅的脂肪酶、淀粉酶和消化酶活性, 也能间接体现适当比例的菜粕替代鱼粉并未对大鳞副泥鳅的生长性能产生负面影响。Azarm等[29]研究在黑鲷幼鱼饲料中添加不同比例发酵豆粕, 结果表明, 在不同发酵豆粕替代水平下黑鲷幼鱼肠道的消化酶活性均无显著变化; Zhang 等[30]研究在大黄鱼饲料中不同比例豆粕替代鱼粉, 结果表明, 随着豆粕替代比例的增加, 肠道胰蛋白酶活性显著降低, 而脂肪酶活性先升高后降低, 淀粉酶活性无显著影响。
3.4 菜粕替代鱼粉对大鳞副泥鳅肠道生化指标、抗氧化能力的影响
大鳞副泥鳅的肠道除了具有消化功能, 还具有免疫功能和多种应激反应。由于众多应激反应中都普遍存在氧化应激, 这决定了鱼体肠道抗氧化能力能够间接反映鱼类肠道功能是否正常的发挥[31]。CAT、SOD和T-AOC等是关键的抗氧化酶, 这些抗氧化酶在体液免疫系统中起着重要作用, 也在机体抵抗氧化应激过程中发挥重要作用[32, 33]。SOD可将超氧阴离子自由基还原为过氧化氢, 且在GSH-PX和CAT作用下将过氧化氢分解为水和氧气[34]。MDA是脂质过氧化的产物, 其含量间接反映了体内活性氧自由基的含量和组织细胞脂质过氧化程度[35, 36]。
本试验结果显示, 大鳞副泥鳅的CAT、SOD和T-AOC活性并未随菜粕替代比例的上升出现显著性差异, 但SOD与T-AOC的活性都随替代比例的上升有所增加。值得一提的是, T-AOC随菜粕替代鱼粉的比例上升在P40组时下降, 这与陈晨[37]对凡纳滨对虾进行菜粕、发酵菜粕替代鱼粉试验中肝胰腺的结果类似。MDA和AKP的含量随着菜粕替代比例的上升呈现上升趋势, 这一变化体现出菜粕替代比例的增加对大鳞副泥鳅的肠道产生了一定的损伤。肠道作为大鳞副泥鳅主要的消化器官, 也具有呼吸和免疫功能。鱼类肠道的完整极为重要, 鱼类的肠黏膜厚度远远低于哺乳动物, 且随着鱼类的进食经常受到外界物质的侵扰, 容易引起免疫应答[38, 39]。经研究发现, 由于菜粕中含有单宁, 当单宁的总含量在1.2%—3.7%时, 会对消化道产生负面影响[40, 41]; 姚静婷[8]在试验中发现, 菜粕会对暗纹东方鲀的肠道和抗氧化能力产生一定影响, 这可能是由于单宁会分解产物在动物体内形成促抗氧化剂中间体[42]; Nemcsok等[43]发现给鲤注射10 mg/kg的水解单宁会使MDA含量增加, 抗氧化酶活性受到抑制。多项研究表明, 高含量的菜粕会由于其含有的抗氧化因子对水产动物机体产生负面影响, 这与本试验肠道抗氧化能力降低的结果一致[8, 44—47]。
3.5 菜粕替代鱼粉对大鳞副泥鳅肝脏生化指标、抗氧化能力的影响
肝脏SOD和CAT是动物体内清除自由基的重要抗氧化酶, 当动物体的新陈代谢受到外界影响, 细胞内会产生过多带有氧化性的自由基, 同时机体会提高抗氧化酶的活性以降低活性自由基的伤害, 但若损伤进一步加剧, 酶活性则会回落甚至被抑制, 导致膜脂质过氧化产物MDA增加[42, 48]。MDA是脂质过氧化的产物, 过多的MDA会降低机体抗氧化性能从而造成细胞损伤[49]。GOT和GPT是鱼体内最重要的氨基酸转运酶, 其活性通常被作为判断肝脏损伤的重要指标[50]。在本试验中, SOD各组数据都与对照组呈显著性下降, GOT除P10组外都与对照组呈显著性上升。GOT的活性呈上升趋势, GPT和MDA则与之不同, GPT呈下降趋势, MDA呈先下降后上升趋势。GPT的下降趋势有别于GOT的上升趋势, 可能是肝细胞大量坏死时, 出现了酶胆分离现象, 导致GPT出现下降现象。MDA的下降趋势可能是动物蛋白源和植物蛋白源产生互补效应, 低比例替代鱼粉所增加的抗营养因子对肝脏的损伤不大, 当替代比例逐渐上升, 肝脏负荷随之上升, 致使肝脏的肝功能受损。由此可以推出随着菜粕替代鱼粉比例的上升, 大鳞副泥鳅的肝脏组织受到一定损伤, 30%—50%肝脏损伤较为明显。经多项研究表明, 饲料中添加过量的菜粕会对鱼体的肝脏造成一定的损伤, 不同的鱼引起肝损伤的菜粕量有着较大差距[22, 51, 52]。值得注意的是, 蒋春琴等[53]发现饲料中菜粕含量为60%时, 异育银鲫的肝脏出现受损情况; 林仕梅等[20]发现菜粕和棉粕的用量为58%时, 罗非鱼的肝功能已受到损害。本试验结果显示, 菜粕替代比例在30%—40%时, 大鳞副泥鳅的肝功能已受到损害。
3.6 菜粕替代鱼粉对大鳞副泥鳅肠道形态学的影响
鱼类的肠道可以吸收营养物质并抵御外界微生物、细菌和有毒物质进入鱼体, 因此肠道组织可以间接反映营养吸收的效率,当肠道结构受到损伤时, 鱼体对营养物质的吸收效率会降低[54, 55]。肠道绒毛的主要作用是捕捉营养物质并消化吸收,肠道绒毛高度增加意味着增加肠上皮细胞和营养物质之间的接触面积, 从而使提高消化吸收效率。王杰等[6]发现菜粕替代饲料中37.5%鱼粉会显著降低了翘嘴鳜(Siniperca chuatsi)肠道的绒毛高度和绒毛密度, 增加了肠壁厚度且造成肠绒毛大量脱落; Zhang等[30]研究发现当豆粕替代比例达为40%—45%时, 大黄鱼的肠壁会明显变薄, 小肠绒毛会受到机械性的损伤; Iqbal等[56]研究发现用菜粕完全替代鱼粉和豆粕, 会导致尼罗罗非鱼的肠道出现死亡细胞数量增多、炎症及组织壁和绒毛完全变性等现象; 黄莹等[3]发现饲料中双低菜粕替代比例的提高, 克氏原螯虾幼虾肠道受损程度逐步加深。本试验结果显示, 随着菜粕替代比例的上升, 大鳞副泥鳅的肠道绒毛高度逐渐减小, 50%时肠道绒毛高度与对照组显著性下降, 其他各组未表现出显著性差异, 但呈现下降趋势。此外, 绒毛高度/隐窝深度(V/C)的比值仅10%替代比例时, 与对照组相比呈现显著性增大, 其他各组无显著性差异, 这与Wu等[57]的研究结果类似。肌层厚度随着菜粕替代比例的增加呈现出下降趋势, 50%时肌层厚度数值最低且与对照组相比表现出显著性下降。经韩庆炜等[58]研究发现, 不同饲料原料对鲈鱼的肠道结构有着不同的影响, 本试验结果和其他植物蛋白源饲料[59, 60]对鱼类造成的肠道结构变化不一样。
4. 结论
初始空段落
本研究结果表明, 10%—40%的菜粕替代比例不会对大鳞副泥鳅的增重率和特定生长率产生显著性影响。当饲料中菜粕替代鱼粉的比例为50%时, 会对大鳞副泥鳅的生长性能和抗氧化能力产生负面影响, 损坏其肠道组织结构, 会影响大鳞副泥鳅的摄食、消化和生长发育及健康状况。
-
表 1 试验饲料配方及主要营养物质(% 干物质基础)
Table 1 Ingredient and proximate compositions of the experimental diets (% dry matter)
原料Ingredient 菜粕替代水平比例Proportion of rapeseed meal substitution level 0 10% 20% 30% 40% 50% 鱼粉Fish meal 25.00 22.50 20.00 17.50 15.00 12.50 豆粕Soybean meal 20.00 20.00 20.00 20.00 20.00 20.00 菜粕Rapeseed meal 6.00 8.50 11.00 13.50 16.00 18.50 小麦粉Wheat starch 24.00 24.00 24.00 24.00 24.00 24.00 鱼油Fish oil 2.50 2.50 2.50 2.50 2.50 2.50 豆油Sopybean oil 2.50 2.50 2.50 2.50 2.50 2.50 60%胆碱60% Choline 0.40 0.40 0.40 0.40 0.40 0.40 酪蛋白Casein 0.12 1.00 1.89 2.78 3.66 4.54 大豆浓缩蛋白Soybean protein concentrate 10.00 10.00 10.00 10.00 10.00 10.00 大豆卵磷脂Soybean lecithin 1.00 1.00 1.00 1.00 1.00 1.00 磷酸二氢钙 Ca(H2PO4)2 2.00 2.00 2.00 2.00 2.00 2.00 赖氨酸 Lys 0.00 0.03 0.05 0.07 0.10 0.12 蛋氨酸 Met 0.00 0.01 0.01 0.01 0.01 0.01 微晶纤维素Microcrystalline cellulose 5.48 4.56 3.65 2.74 1.83 0.93 预混料Vitamin and mineral premix1 1.00 1.00 1.00 1.00 1.00 1.00 合计Total 100.00 100.00 100.00 100.00 100.00 100.00 营养水平Proximate composition2 (%) 粗蛋白Crude protein 36.38 36.55 36.68 36.26 36.33 36.50 粗脂肪Crude fat 6.99 6.78 7.10 6.87 7.00 7.11 粗灰分Ash 8.03 7.92 7.74 7.50 7.44 7.57 总能Gross energy (kJ/g) 17.04 17.08 17.13 17.17 17.21 17.25 注: 1预混料为每千克饲料提供: VA 5000 IU; VB1 25 mg; VB2 45 mg; VB6 20 mg; VB12 0.1 mg; VK3 10 mg; VE 200 mg; VC 200 mg; VD3 2500 IU; 肌醇200 mg; 泛酸60 mg; 烟酸200 mg; 叶酸10 mg; 生物素1.5 mg; NaSeO3·5H2O 0.3 mg; CoCl2·6H2O 0.4 mg; KI 0.8 mg; CuSO4·5H2O 10 mg; MnSO4·4H2O 20 mg; ZnSO4·H2O 50 mg; FeSO4·7H2O 150 mg; MgSO4·7H2O 500 mg; NaCl 1 000 mg; 2营养水平为实测值1The premix provided the followings per kg of diet: VA 5000 IU; VB1 25 mg; VB2 45 mg; VB6 20 mg; VB12 0.1 mg; VK3 10 mg; VE 200 mg; VC 200 mg; VD3 2500 IU; inositol 200 mg; pantothenic acid 60 mg; nicotinic acid 200 mg; folic acid 10 mg; biotin 1.5 mg; NaSeO3·5H2O 0.3 mg; CoCl2·6H2O 0.4 mg; KI 0.8 mg; CuSO4·5H2O 10 mg; MnSO4·4H2O 20 mg; ZnSO4·H2O 50 mg; FeSO4·7H2O 150 mg; MgSO4·7H2O 500 mg; NaCl 1 000 mg; 2Nutrient levels were measured values 表 2 菜粕替代鱼粉对大鳞副泥鳅生长性能的影响
Table 2 Effects of rapeseed meal instead of fishmeal on the growth performance of Paramisgurnus dabryanus
指标 Index P0 P10 P20 P30 P40 P50 初重IBW (g) 5.12±0.02 5.06±0.04 5.12±0.03 5.05±0.01 5.07±0.04 5.06±0.04 末重FBW(g) 14.21±0.46a 14.25±0.11a 13.65±0.24a 13.79±0.19a 14.17±0.22a 12.74±0.27b 增重率WGR (%) 177.06±10.22a 182.05±2.19a 163.79±4.17a 176.10±5.43ab 175.01±4.51a 144.32±9.47b 特定生长率SGR (%) 1.70±0.06a 1.73±0.01a 1.62±0.03a 1.69±0.03a 1.68±0.03a 1.49±0.07b 饲料系数FCR 1.59±0.13ab 1.56±0.04b 2.00±0.24a 1.73±0.06a 1.70±0.02ab 2.03±0.11ab 肥满度CF (g/cm3) 0.93±0.03ab 0.88±0.01ab 0.94±0.01a 0.90±0.02ab 0.90±0.01b 0.93±0.01ab 蛋白质效率PER 1.75±0.22a 1.76±0.08a 1.42±0.28b 1.60±0.12ab 1.62±0.03ab 1.37±0.15b 蛋白沉积率PDR (%) 0.28±0.02a 0.26±0.01ab 0.22±0.02abc 0.23±0.01abc 0.24±0.00abc 0.21±0.01c 脂肪沉积率FDR (%) 0.60±0.04ab 0.67±0.01b 0.53±0.04ab 0.61±0.01 ab 0.62±0.00ab 0.54±0.04b 注: 蛋白沉积率和脂肪沉积率计算使用湿物质基础下的粗蛋白和粗脂肪占比; 同一行相同右上角含有相同英文上标字母或无上标表示无显著差异(P<0.05); 下同Note: The PDR and FDR are calculated as the proportion of crude protein and crude lipid on a wet material basis; In the same row, values with superscript letter or no superscript indicate significantly difference (P<0.05); the same applies below 表 3 菜粕替代鱼粉对大鳞副泥鳅全鱼营养成分的影响 (%干物质基础)
Table 3 Effects of rapeseed meal instead of fishmeal on whole body composition of Paramisgurnus dabryanus (% dry basic)
成分Ingredient P0 P10 P20 P30 P40 P50 水分Moisture 73.15±0.19 72.87±1.26 73.13±0.36 73.87±0.09 73.18±0.67 72.71±0.42 粗蛋白Crude protein 60.39±0.54a 56.65±1.27b 59.38±0.71ab 57.24±0.54b 57.78±0.06ab 57.46±0.32ab 粗脂肪Crude lipid 20.27±0.26b 21.18±0.22ab 21.16±0.49ab 22.15±0.83a 22.18±0.16a 21.45±0.88ab 粗灰分Ash 9.79±0.34abc 9.86±0.07ab 9.13±0.10bc 10.06±0.18a 9.75±0.41abc 8.98±0.25c 表 4 菜粕替代鱼粉对大鳞副泥鳅血清生化指标的影响
Table 4 Effects of rapeseed meal instead of fishmeal on serum biochemical indexes of Paramisgurnus dabryanus
指标Index P0 P10 P20 P30 P40 P50 甘油三酯TG (mmol/L) 2.34±0.09 3.09±0.13 3.12±0.42 2.97±0.36 3.27±0.45 2.66±0.38 白蛋白Alb (g/L) 1.30±0.25 1.04±0.02 0.97±0.01 1.02±0.06 1.00±0.01 1.04±0.06 葡萄糖GLU (mmol/L) 3.70±0.18c 4.29±0.22bc 4.26±0.55bc 4.64±0.21ab 4.83±0.12ab 5.36±0.19a 血尿素氮BUN (mmol/L) 50.77±1.87b 53.55±1.49b 64.80±1.89a 52.58±2.31b 54.73±4.66b 54.00±1.32b 补体3 C3 (U/L) 393.95±25.65abc 423.90±5.85a 363.92±6.31c 420.90±5.41ab 379.22±3.57bc 425.68±15.77a 补体4 C4 (U/L) 305.72±21.82 316.83±5.78 321.33±10.30 309.65±8.45 327.83±6.17 328.50±7.15 溶菌酶LZM (U/L) 13.25±0.38a 13.03±0.52ab 13.55±0.68a 13.05±0.32ab 13.15±0.33ab 11.75±0.28b 表 5 菜粕替代鱼粉对大鳞副泥鳅消化酶活性的影响
Table 5 Effects of rapeseed meal instead of fishmeal on digestive enzyme activity of Paramisgurnus dabryanus (U/mgprot)
消化酶Digestive enzyme P0 P10 P20 P30 P40 P50 脂肪酶LPS 1.31±0.14b 2.49±0.26a 1.64±0.11b 1.91±0.20ab 1.77±0.21b 1.82±0.21b 淀粉酶AMS 1.28±0.24ab 0.57±0.15b 0.99±0.15ab 1.56±0.28a 1.44±0.47ab 1.87±0.28a 胰蛋白酶Trypsin 4836.87±189.00bc 4751.95±176.82bc 4957.16±128.76abc 4507.49±123.04c 5258.53±148.55ab 5452.12±220.94a 表 6 菜粕替代鱼粉对大鳞副泥鳅肠道生化指标、抗氧化能力的影响
Table 6 Effects of substitution of fishmeal with rapeseed meal on intestinal biochemical indices and antioxidant capacity of Paramisgurnus dabryanus
指标Index P0 P10 P20 P30 P40 P50 总蛋白TP (μg/mL) 962.95±32.73 994.44±29.45 971.57±34.50 898.81±20.46 870.82±101.43 867.59±15.18 过氧化氢酶CAT (U/gprot) 4.04±0.39 4.13±0.12 3.43±0.26 3.91±0.45 4.32±0.18 4.33±0.13 超氧化物歧化酶SOD (U/mgprot) 25.94±2.33 30.68±1.96 29.47±1.34 27.28±0.20 33.31±3.94 26.83±1.96 总抗氧化能力T-AOC (mM) 0.31±0.04a 0.38±0.03a 0.40±0.00a 0.30±0.00a 0.18±0.02b 0.34±0.06a 丙二醛MDA (nmol/mgprot) 5.90±0.38ab 5.08±0.26b 4.94±0.07b 6.70±0.18ab 6.46±0.82ab 7.38±1.31a 碱性磷酸酶AKP (金氏单位/g) 7.88±0.08b 7.23±1.37b 9.41±0.41ab 11.26±2.41ab 13.99±1.77a 9.93±1.55ab 表 7 菜粕替代鱼粉对大鳞副泥鳅肝脏生化指标、抗氧化能力的影响
Table 7 Effects of substitution of fishmeal with rapeseed meal on liver biochemical indices and antioxidant capacity of Paramisgurnus dabryanus
指标Index P0 P10 P20 P30 P40 P50 过氧化氢酶CAT (U/gprot) 31.83±3.53 35.22±2.22 32.26±1.03 36.41±2.06 32.29±0.86 35.96±2.12 超氧化物歧化酶SOD (U/mgprot) 35.98±3.51a 25.32±0.38b 22.25±2.27b 27.16±2.71b 20.06±1.20b 24.33±4.20b 谷草转氨酶GOT (U/gprot) 12.40±0.57c 14.80±1.18c 21.26±0.32b 18.81±2.02b 20.07±0.57b 43.42±1.78a 谷丙转氨酶GPT (U/gprot) 3.83±0.27a 1.33±0.18b 1.77±0.01b 1.35±0.57b 2.14±0.53b 1.81±0.46b 总抗氧化能力T-AOC (mM) 0.29±0.02 0.17±0.02 0.14±0.03 0.25±0.06 0.22±0.09 0.14±0.02 丙二醛MDA (nmol/mgprot) 1.51±0.08ab 1.31±0.01b 1.49±0.05ab 1.65±0.08ab 1.65±0.24ab 1.69±0.04a 表 8 菜粕替代鱼粉对大鳞副泥鳅肠道形态学的影响
Table 8 Effects of rapeseed meal instead of fishmeal on intestinal morphology of Paramisgurnus dabryanus
指标Index P0 P10 P20 P30 P40 P50 绒毛高度Villus height (um) 626.49±77.26ab 737.44±90.28a 620.46±9.93a 570.27±76.65ab 616.72±26.65ab 487.08±29.47b 隐窝深度Crypt depth (um) 42.88±3.83a 31.00±2.82b 44.82±3.15a 37.97±4.44b 37.61±3.96ab 26.86±2.53b 肌层厚度Muscle thickness (um) 178.35±10.20b 192.43±15.53b 260.65±13.97a 228.28±1.75ab 203.92±14.27b 229.89±27.17ab 绒毛高度/隐窝深度V/C 14.69±1.52b 20.44±0.83a 13.26±0.34b 16.73±1.29ab 16.90±2.40ab 16.35±1.55ab -
[1] Butler E J, Pearson A W, Fenwick G R. Problems which limit the use of rapeseed meal as a protein source in poultry diets [J]. Journal of the Science of Food and Agricul ture., 1982, 33(9): 866-875. doi: 10.1002/jsfa.2740330909
[2] 刘晓庆, 朱晓鸣, 韩冬, 等. 饲料鱼粉、菜粕比例对异育银鲫生长和饲料利用的影响 [J]. 水生生物学报, 2014, 38(4): 657-663.] doi: 10.7541/2014.93 Liu X Q, Zhu X M, Han D, et al. Effects of dietary ratio of fish meal and rapeseed meal on the growth and feed utilization in gibel carp(Carassius auratus gibelio) [J]. Acta Hydrobiologica Sinica, 2014, 38(4): 657-663. [ doi: 10.7541/2014.93
[3] 黄莹, 娄格格, 刘轩宇, 等. 双低菜粕替代鱼粉对克氏原螯虾幼虾生长性能、抗氧化能力和消化系统组织形态的影响 [J]. 水生生物学报, 2023, 47(12): 1918-1931.] doi: 10.7541/2023.2022.0458 Huang Y, Lou G G, Liu X Y, et al. Replacing fish meal with rapeseed meal on growth performance, antioxidant capacity and digestive system morphology of juvenile Procambarus clarkii [J]. Acta Hydrobiologica Sinica, 2023, 47(12): 1918-1931. [ doi: 10.7541/2023.2022.0458
[4] 伍代勇, 叶元土, 张宝彤, 等. 4种植物蛋白对凡纳滨对虾生长、非特异性免疫和体成分的影响 [J]. 上海海洋大学学报, 2009, 18(2): 2174-2180.] Wang D Y, Ye Y T, Zhang B T, et al. Effects of four plant proteins on the growth, non-specific immunity and body composition of Litopenaeus vannamei [J]. Journal of Shanghai Ocean University, 2009, 18(2): 2174-2180. [
[5] 胡秀聪, 刘建高, 陈宇航, 等. 菜粕替代面粉对黄颡鱼生长性能和形体指标的影响 [J]. 广东饲料, 2021, 30(8): 23-26.] doi: 10.3969/j.issn.1005-8613.2021.08.007 Hu X C, Liu J G, Chen Y H, et al. Effects of replacing flour with rapeseed meal on growth performance and body indexes of Pelteobagrus fulvidraco [J]. Guangdong Feed, 2021, 30(8): 23-26. [ doi: 10.3969/j.issn.1005-8613.2021.08.007
[6] 王杰, 梁旭方, 李姣, 等. 菜粕替代鱼粉对翘嘴鳜肠道吸收和氨基酸代谢的影响 [J]. 华中农业大学学报, 2018, 37(4): 93-101.] Wang J, Liang X F, Li J, et al. Effect of substituting fish meal with rapeseed meal on intestinal absorption and amino acids metabolism in Chinese perch(Siniperca chuatsi) [J]. Journal of Huazhong Agricultural University, 2018, 37(4): 93-101. [
[7] 崔存河, 杨成辉, 卜宪勇, 等. 菜粕替代鱼粉对虹鳟(Oncorhynchus mykiss)生长、体组成和血液学指标的影响 [J]. 饲料工业, 2016, 37(22): 21-25.] Cui C H, Yang C H, Bu X Y, et al. Effect of replacing fish meal with rapeseed meal on growth, body composition and serum biochemical parameter of rainbow trout(Oncorhynchus mykiss) [J]. Feed industry, 2016, 37(22): 21-25. [
[8] 姚静婷. 菜粕及水解单宁对暗纹东方鲀及草鱼健康及营养代谢的影响[D]. 上海海洋大学, 2020, 120-144.] Yao J T. Effects of rapeseed meal and hydrolyzed tannin on health and nutritional metabolism of Fugu obscurus and grass carp[D]. Shanghai: Shanghai Ocean University, 2020, 120-144.
[9] 孙述好, 胡男, 黄紫薇, 等. 大鳞副泥鳅皮肤抗氧化酶活性的昼夜节律研究 [J]. 黑龙江水产, 2023, 42(1): 19-21.] doi: 10.3969/j.issn.1674-2419.2023.01.004 Sun S H, Hu N, Huang Z W, et al. Study on the circadian rhythm of antioxidant enzyme activity in skin of Paraphyloach dabrous [J]. Northern Chinese Fisheries, 2023, 42(1): 19-21. [ doi: 10.3969/j.issn.1674-2419.2023.01.004
[10] 李雪, 赵建, 王玮欣, 等. 盐度对大鳞副泥鳅抗氧化酶及组织结构的影响 [J]. 水生态学杂志, 2022, 43(6): 139-145.] Li X, Zhao J, Wang W X, et al. Effects of salinity on antioxidant enzymes and histological structure of Paramisgurnus dabryanus [J]. Journal of Hydroecology, 2022, 43(6): 139-145. [
[11] 李佑杰, 陈琪, 袁志文, 等. 饲料中添加丙氨酰-谷氨酰胺对大鳞副泥鳅生长性能、血清生化指标、肝脏抗氧化能力以及肠道消化酶活性和形态结构的影响 [J]. 动物营养学报, 2024, 36(5): 3219-3230.] doi: 10.12418/CJAN2024.276 Li Y J, Chen Q, Yuan Z W, et al. Effects of dietary Alanyl-Glutamine supplementation on growth performance, serum biochemical indices, liver antioxidant capacity, intestinal digestive enzyme activities and morphological structure of Paramisgurnus dabryanus [J]. Chinese Journal of Animal Nutrition, 2024, 36(5): 3219-3230. [ doi: 10.12418/CJAN2024.276
[12] 马成, 王文博, 张克顺, 等. 菜粕发酵及应用研究进展 [C]//中国畜牧兽医学会动物微生态学分会第五届第十三次全国学术研讨会论文集, 2018: 116-119.] Ma C, Wang W B, Zhang K S, et al. Research progress on rapeseed meal fermentation and application [C]//Proceedings of the 13th National Symposium of the 5th and 13th National Academic Symposium of the Animal Microecology Branch of the Chinese Association of Animal Husbandry and Veterinary Medicine, 2018: 116-119. [
[13] 钟晓霞, 刘志云, 周晓容, 等. 发酵菜粕在畜禽养殖中的应用研究进展 [J]. 饲料工业, 2018, 39(19): 44-48.] Zhong X X, Liu Z Y, Zhou X R, et al. Development status and application of fermented rapeseed meal in livestock and poultry breeding [J]. Feed industry, 2018, 39(19): 44-48. [
[14] Vuorela S, Meyer A S, Heinonen M. Impact of isolation method on the antioxidant activity of rapeseed meal phenolics [J]. Journal of Agricultural and Food Chemistry, 2004, 52(26): 8202-8207. doi: 10.1021/jf0487046
[15] Leslie A J, Summers J D. Amino acid balance of rapeseed meal [J]. Poultry Science, 1975, 54(2): 532-538. doi: 10.3382/ps.0540532
[16] 张恒, 刘立鹤, 贺国龙, 等. 凡纳滨对虾饲料中菜籽粕替代鱼粉适宜比例的研究 [J]. 水产科学, 2011, 30(10): 591-596.] doi: 10.3969/j.issn.1003-1111.2011.10.001 Zhang H, Liu L H, He G L, et al. Proper proportion of rapeseed meal substitution for fish meal in diet of pacific white leg shrimp Litopenaeus vannamei [J]. Fisheries Science, 2011, 30(10): 591-596. [ doi: 10.3969/j.issn.1003-1111.2011.10.001
[17] 黄云, 胡毅, 肖调义, 等. 双低菜粕替代豆粕对青鱼幼鱼生长及生理生化指标的影响 [J]. 水生生物学报, 2012, 36(1): 41-48.] doi: 10.3724/SP.J.1035.2012.00041 Huang Y, Hu Y, Xiao T Y, et al. Influence of dietary canola meal levels on growth and biochemical indices in juvenile mylopharvngodon piceus [J]. Acta Hydrobiologica Sinica, 2012, 36(1): 41-48. [ doi: 10.3724/SP.J.1035.2012.00041
[18] 杨耐德, 符广才. 凡纳滨对虾饲料中发酵豆粕替代鱼粉的研究 [J]. 饲料工业, 2008, 29(10): 24-26.] doi: 10.3969/j.issn.1001-991X.2008.10.008 Yang N D, Fu G C. Study on replacing fish meal with fermented soybean meal in Litopenaeus vannamei feed [J]. Feed industry, 2008, 29(10): 24-26. [ doi: 10.3969/j.issn.1001-991X.2008.10.008
[19] 高贵琴, 熊邦喜, 赵振山, 等. 不同水平双低菜粕替代蛋白对鱼类生长的影响 [J]. 水利渔业, 2004, 24(3): 55-57.] doi: 10.3969/j.issn.1003-1278.2004.03.021 Gao G Q, Xiong B X, Zhao Z S, et al. Effects of different levels of double-low rapeseed meal replacement protein on fish growth [J]. Water conservancy and fishery, 2004, 24(3): 55-57. [ doi: 10.3969/j.issn.1003-1278.2004.03.021
[20] 林仕梅, 麦康森, 谭北平. 菜粕、棉粕替代豆粕对奥尼罗非鱼(Oreochromis niloticus×O. aureus)生长、体组成和免疫力的影响 [J]. 海洋与湖沼, 2007(2): 168-173.] doi: 10.3321/j.issn:0029-814X.2007.02.013 Lin S M, Mai K S, Tan B P. Effect of soybean meal replacement by rapeseed-cottonseed compound on growth, body composition and immunity of tilapia Oreochromis niloticus×O. aureus [J]. Oceanologia Et LimnologiaI Sinica, 2007(2): 168-173. [ doi: 10.3321/j.issn:0029-814X.2007.02.013
[21] Davies S J, McConnell S, Bateson R I. Potential of rapeseed meal as an alternative protein source in complete diets for Tilapia(Oreochromis mossambicus Peters) [J]. Aquaculture, 1990, 87(2): 145-154. doi: 10.1016/0044-8486(90)90271-N
[22] 马利, 黄峰, 吴建开, 等. 不同菜粕水平对草鱼生长、血清生化指标和毒素残留的影响 [J]. 水产学报, 2005, 29(6): 798-803.] Ma L, Huang F, Wu J K, et al. Effects of different rapeseed meal levels on growth, serum biochemical indices and toxins residues in Ctenopharyngodon [J]. Journal of Fisheries of China, 2005, 29(6): 798-803. [
[23] Coma J, Carrion D, Zimmerman D R. Use of plasma urea nitrogen as a rapid response criterion to determine the lysine requirement of pigs [J]. Journal of Animal Science, 1996, 73(2): 472-481.
[24] Mori K, Nakanishi T, Suzuki T, et al. Defense mechanisms in invertebrates and fish [J]. Tanpakushitsu Kakusan Koso Protein, Nucleic Acid, Enzyme, 1989, 34(3): 214-223.
[25] 陈晓晓, 孙琛, 刘畅, 等. LncRNA与肝脏糖脂代谢的研究进展 [J]. 生物工程学报, 2021, 37(1): 40-52.] Chen X X, Sun C, Liu C, et al. lncRNA in hepatic glucose and lipid metabolism: a review [J]. Chinese Journal of Biotechnology, 2021, 37(1): 40-52. [
[26] 易军, 王淮, 王巍, 等. 菜粕日粮对育肥牛生产性能及血液生化指标的影响 [J]. 黑龙江畜牧兽医, 2014(7): 21-25.] Yi J, Wang H, Wang W, et al. Effects of rapeseed meal diets on productive performance and blood biochemical indicators of fattening beef cattle [J]. Heilongjiang Animal Science and Veterinary Medicine, 2014(7): 21-25. [
[27] Luo G, Xu J, Teng Y, et al. Effects of dietary lipid levels on the growth, digestive enzyme, feed utilization and fatty acid composition of Japanese sea bass(Lateolabrax japonicus L. ) reared in freshwater [J]. Aquaculture research, 2010, 41(2): 210-219. doi: 10.1111/j.1365-2109.2009.02319.x
[28] Wan J J, Xi Q K, Tang J Q, et al. Effects of pelleted and extruded feed on growth performance, intestinal histology and microbiota of Juvenile red swamp crayfish (Procambarus clarkii) [J]. Animals, 2022, 12(17): 2252. doi: 10.3390/ani12172252
[29] Azarm H M, Lee S M. Effects of partial substitution of dietary fish meal by fermented soybean meal on growth performance, amino acid and biochemical parameters of juvenile black sea bream Acanthopagrus schlegeli [J]. Aquaculture Research., 2014, 45(6): 994-1003. doi: 10.1111/are.12040
[30] Zhang F, Zhang W B, Mai K S, et al. Effects of replacement of dietary fish meal by soybean meal on growth, digestive enzyme activity and digestive tract histology of juvenile large yellow croaker, Pseudosciaena crocea R [J]. Periodical of Ocean University of China, 2012, 42: 75-82.
[31] 孙敬锋, 贾艳丽. 鱼类肠道菌群与免疫调节研究进展 [J]. 水产科技情报, 2016, 43(2): 96-100.] Sun J F, Jia Y L. Research progress of fish intestinal flora and immune regulation [J]. Fishing science and Technology Information, 2016, 43(2): 96-100. [
[32] Hou S Q, Li J Y, Huang J, et al. Effects of dietary phospholipid and cholesterol levels on antioxidant capacity, nonspecial immune response and intestinal microflora of juvenile female crayfish, Procambarus clarkii [J]. Aquaculture Reports, 2022(25): 101245.
[33] Zhao D , Zhang X N, Liu D S, et al. Cu accumulation, detoxification and tolerance in the red swamp crayfish Procambarus clarkii [J]. Ecotoxicology and Environmental Safety, 2019, 175: 201-207.
[34] Martínez-Álvarez R M, Morales A E, Sanz A. Antioxidant defenses in fish: biotic and abiotic factors [J]. Reviews in Fish Biology and Fisheries, 2005, 15(1-2): 75-88. doi: 10.1007/s11160-005-7846-4
[35] Liu Y L, Zhong L, Chen T, et al. Dietary sanguinarine supplementation on the growth performance, immunity and intestinal health of grass carp(Ctenopharyngodon idellus) fed cottonseed and rapeseed meal diets [J]. Aquaculture, 2020, 528: 735521. doi: 10.1016/j.aquaculture.2020.735521
[36] 曹锡清. 脂质过氧化对细胞与机体的作用 [J]. 生物化学与生物物理进展, 1986, 13(2): 17-23.] Cao X Q. Effects of lipid peroxidation on cells and organism [J]. Progress in Biochemistry and Biophysics, 1986, 13(2): 17-23. [
[37] 陈晨. 菜粕、发酵菜粕替代鱼粉及添加异硫氰酸酯对凡纳滨对虾(Litopenaeus vannamei)生长、生理生化和代谢的影响 [D]. 上海: 上海海洋大学, 2023: 65-81.] Chen C. Effect of rapeseed meal, fermented rapeseed meal substituting fishmeal and dietary isothiocyanate on growth, physiology, biochemistry and metabolism of Litopenaeus vannamei [D]. Shanghai: Shanghai Ocean University, 2023: 65-81. [
[38] Epstein M D. Increased gut permeability following burn trauma [J]. Archives of Surgery, 1991, 126(2): 198. doi: 10.1001/archsurg.1991.01410260086012
[39] Luo J B, Feng L, Jiang W D, et al. The impaired intestinal mucosal immune system by valine deficiency for young grass carp (Ctenopharyngodon idella) is associated with decreasing immune status and regulating tight junction proteins transcript abundance in the intestine [J]. Fish & Shellfish Immunology, 2014, 40(1): 197-207.
[40] Hervás G, Pérez V, Giráldez F J, et al. Intoxication of sheep with quebracho tannin extract [J]. Journal of Comparative Pathology, 2003, 129(1): 44-54. doi: 10.1016/S0021-9975(02)00168-8
[41] 刘平, 孙林, 曾作财, 等. 菜籽粕中单宁的固态发酵降解和条件优化 [J]. 饲料研究, 2018, 41(4): 70-75.] Liu P, Sun L, Zeng Z C, et al. Degradation of tannin in rapeseed meal by solid-state fermentation and optimization of conditions [J]. Feed research, 2018, 41(4): 70-75. [
[42] 姚静婷, 孔纯, 华雪铭, 等. 水解单宁对暗纹东方鲀摄食偏好、消化代谢和抗氧化能力的效应研究 [J]. 水产学报, 2019, 43(6): 1449-1462.] Yao J T, Kong C, Hua X M, et al. Effects of supplemental hydrolysable tannin on feeding preference, nutrition digestion and antioxidant ability of obscure puffer (Takifugu fasciatus) [J]. Journal of Fisheries of China, 2019, 43(6): 1449-1462. [
[43] Varanka Z, Rojik I, Varanka I, et al. Biochemical and morphological changes in carp (Cyprinus Carpio L. )liver following exposure to copper sulfate and tannic acid [J]. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology, 2001, 128(3): 467-477.
[44] Bu X Y, Wang Y Y, Chen F Y, et al. An evaluation of replacing fishmeal with rapeseed meal in the diet of Pseudobagrus ussuriensis: growth, feed utilization, nonspecific immunity, and growth-related gene expression [J]. Journal of the World Aquaculture Society, 2017, 49(6): 1068-1080.
[45] 黄辉龙, 邹晓庭. 菜籽饼(粕)中抗营养因子检测方法的研究进展 [J]. 中国饲料, 2010(17): 3-7.] doi: 10.3969/j.issn.1004-3314.2010.17.003 Huang H L, Zou X T. Research advance on methods for determining anti-nutritional factors in rapeseed meal [J]. China Feed, 2010(17): 3-7. [ doi: 10.3969/j.issn.1004-3314.2010.17.003
[46] Burel C, Boujard T, Escaffre A M, et al. Dietary low-glucosinolate rapeseed meal affects thyroid status and nutrient utilization in rainbow trout(Oncorhynchus mykiss) [J]. The British Journal of Nutrition, 2000, 83(6): 653-664. doi: 10.1017/S0007114500000830
[47] Watanabe T, Tanemura N, Sugiura S. Effects of in vitro enzymatic digestion of rapeseed meal, soybean meal, macrophyte meal, and algal meal on in vivo digestibilities of protein and minerals evaluated using common carp(Cyprinus carpio) [J]. Aquaculture Science, 2016, 64(2): 215-222.
[48] 夏超笃, 黄彦, 湛穗璋, 等. 博落回提取物对断奶仔猪生长性能、血清免疫指标及抗氧化指标的影响 [J]. 中国畜牧兽医, 2018, 45(11): 3070-3076.] Xia C D, Huang Y, Zhan S Z, et al. Effects of Macleaya cordata extracts on growth performance, serum immune indexes and antioxidant indexes of weaning piglets [J]. China Animal Husbandry & Veterinary Medicine, 2018, 45(11): 3070-3076. [
[49] Jiang W D, Wen H L, Liu Y, et al. Enhanced muscle nutrient content and flesh quality, resulting from tryptophan, is associated with anti-oxidative damage referred to the Nrf2 and TOR signalling factors in young grass carp(Ctenopharyngodon idella): avoid tryptophan deficiency or excess [J]. Food Chemistry, 2016, 199: 210-219. doi: 10.1016/j.foodchem.2015.12.003
[50] Hemre G I, Waagbø R, Hjeltnes B, et al. Effect of gelatinized wheat and maize in diets for large Atlantic salmon (Salmo salar L.) on glycogen retention, plasma glucose and fish health [J]. Aquaculture Nutrition, 1996, 2(1): 33-39. doi: 10.1111/j.1365-2095.1996.tb00005.x
[51] 张明明, 文华, 蒋明, 等. 饲料菜粕水平对吉富罗非鱼幼鱼生长、肝脏组织结构和部分非特异性免疫指标的影响 [J]. 水产学报, 2011, 35(5): 748-755.] Zhang M M, Wen H, Jiang M, et al. Effects of dietary rapeseed meal levels on growth liver tissue structure and some nonspecific immunity indices of juvenile GIFT tilapia (Oreochromisni loticus) [J]. Journal of fisheries of China, 2011, 35(5): 748-755. [
[52] 吴志新, 覃江凤, 陈孝煊, 等. 双低菜籽粕对草鱼和鲤甲状腺、肝、肾组织结构的影响 [J]. 华中农业大学学报, 2006, 25(4): 426-430.] doi: 10.3321/j.issn:1000-2421.2006.04.021 Wu Z X, Qin J F, Chen X X, et al. The effect of double-low rapeseed meal on the tissue structure of thyroid gland, liver and kidney in grass carp and common carp [J]. Journal of Huazhong Agricultural University, 2006, 25(4): 426-430. [ doi: 10.3321/j.issn:1000-2421.2006.04.021
[53] 蒋春琴, 冷向军, 李小勤, 等. 饲料中菜粕和棉粕的不同配比对异育银鲫生长性能、血浆生化指标和棉酚残留的影响 [J]. 水产学报, 2010, 34(12): 1917-1925.] Jiang C Q, Leng X J, Li X Q, et al. Effects of different proportion of rapeseed meal and cottonseed meal on growth performance, plasma biochemical indicators and gossypol residues of carp(Carassius auratus gibelio) [J]. Journal of Fisheries of China, 2010, 34(12): 1917-1925. [
[54] 何烈华, 邢廷铣, 陈惠萍, 等. 腈在肉鸡体内蓄积和分布特性及其对物质代谢的影响 [J]. 动物营养学报, 1995, 7(3): 15-20.] He L H, Xing T M, Chen H P, et al. Tee characteristics of accumulation and distribution of the nitrile and its effects on metabolism in broiler chickens [J]. Chinese Journal of Animal Nutrition, 1995, 7(3): 15-20. [
[55] 刘佳, 闫子豪, 么宝兰, 等. 鱼类肠道组织结构、功能、影响因素及其保护物质的研究进展 [J]. 水产科技情报, 2023, 50(2): 121-127.] Liu J, Yan Z H, Yao B L, et al. Research progress on the tissue structure, function, influencing factors and protective substances of fish intestine [J]. Fisheries Science & Technology Information, 2023, 50(2): 121-127. [
[56] Iqbal M, Yaqub A, Ayub M. Partial and full substitution of fish meal and soybean meal by canola meal in diets for genetically improved farmed Tilapia (O. niloticus): growth performance, carcass composition, serum biochemistry, immune response, and intestine histology [J]. Journal of Applied Aquaculture, 2022, 34(4): 829-854. doi: 10.1080/10454438.2021.1890661
[57] Wu Z K, Chen J, Ahmed Pirzado S, et al. The effect of fermented and raw rapeseed meal on the growth performance, immune status and intestinal morphology of broiler chickens [J]. Journal of Animal Physiology and Animal Nutrition, 2021, 106(2): 296-307.
[58] 韩庆炜, 梁萌青, 姚宏波, 等. 鲈鱼对7种饲料原料的表观消化率及其对肝脏、肠道组织结构的影响 [J]. 渔业科学进展, 2011, 32(1): 32-39.] doi: 10.3969/j.issn.1000-7075.2011.01.005 Han Q W, Liang M Q, Yao H B, et al. Effects of seven feed ingredients on growth performance, and liver and intestine histology of Lateolabrax japonicas [J]. Progress in Fishery Sciences, 2011, 32(1): 32-39. [ doi: 10.3969/j.issn.1000-7075.2011.01.005
[59] Shi X, Luo Z, Chen G H, et al. Replacement of fishmeal by a mixture of soybean meal and Chlorella meal in practical diets for juvenile crucian carp, Carassius auratus [J]. Journal of the World Aquaculture Society, 2017, 48(5): 770-781. doi: 10.1111/jwas.12403
[60] 张锦秀, 周小秋, 倪学勤, 等. 分离大豆蛋白对幼建鲤生长性能及肠道的影响[J]. 水产学报, 2008, 32(1): 84-90.] Zhang J X, Zhou X Q, Ni X Q, et al. Effects of soybean protein isolate on growth performance and intestine of Cyprinus carpio var. Jian juveniles[J]Journal of Fisheries of China, 2008, 32(1): 84-90.



 下载:
下载: